 产业资讯
产业资讯
 NCCGCP1962
NCCGCP1962  2025-07-23
2025-07-23
 447
447
引言:一场改写行业命运的“质量革命”
十年前的今天,2015年7月22日,国家药监局一纸《关于开展药物临床试验数据自查核查的公告》(第117号文)划破行业沉疴,1622个临床试验项目被要求限期自查,80%的注册申请主动撤回。这场被称为“7·22”的改革,以“刀刃向内”的勇气直面当时国内临床试验数据造假、低水平仿制药充斥等积弊,开启了中国医药产业从“野蛮上市”到“质量为王”的十年蜕变。
十年光阴、白驹过隙,中国临床试验质量、创新药物研发已达到符合国际最高标准。中国医药行业已从“劣币驱逐良币”的仿制药泥潭,成长为全球创新药物第一梯队,细胞、基因治疗等领域全球领先。这一切的起点,正是那场“乱世用重典”的7.22质量革命。
图1 2015年7月22日国家药监局《关于开展药物临床试验数据自查核查的公告》
➤ 历史:十年前的行业困局
2015年之前,中国医药行业深陷多重困境。彼时,国际创新药进入中国需等待十年以上,国人的认知偏差、行政的效率低下再加上部分的不作为,让中国的药物治疗落后国际十到二十年,国内患者仍在用着美国患者已经淘汰的老旧药物,错失最佳治疗时机。每年上市大量的缺乏临床价值的仿制“新”药,上市前临床试验数据“不真实、不完整”成为潜规则,研究者将病例报告表当原始文件、随意修改数据成常态;低水平类似药重复申报,18600余件积压的药品注册申请中,化药占比超80%,“劣币驱逐良币”导致本土创新几乎停滞,患者面临“治疗效果差、用药选择少”的困境。一位资深药企高管回忆:“当时行业默认‘补数据’是常态,公告发布后,我们一夜之间撤回了8个在审品种。”这些积弊不仅制约产业发展,更让中国在全球药物研发体系中沦为“跟跑者”,与国际先进水平差距不断拉大。
➤ 改革:以“四个最严”破局沉疴
目睹医药领域积弊后,国家迅速意识到问题严重,果断提出改革。面对行业乱象,药监局领导以贯彻习近平总书记“最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责”为核心,掀起了力度空前的改革。
铁腕治假,重塑底线。117号文要求企业对照临床试验方案全面自查,临床试验机构对所承担项目真实性负责,涵盖数据一致性、仪器运行记录、受试者信息等七大核心内容,明确“数据不真实即撤回”。有别于其他领域,药监局领导与行业专家真刀实枪地把文件上的每一条要求变成了实际的工作,丝毫不打折扣。哪怕是2015、2016两年跨国CRO中国区业务量骤降60%,二十多家三甲医院临床试验机构因违规被“关停”,都丝毫没有动摇行业改革“铁面无私、真正执法”的决心。
严格要求,并不是斩尽杀绝,一棍子打死,而是有序扶持,高标准要求。药监局领导在改革之初就把目标放在了国际化,要让中国临床试验和新药研发行业标准接轨国际,融入全球。2017年,国家药监局成功加入ICH(国际人用药品注册技术协调会),推动中国药物临床试验质量管理规范(GCP)与国际最高标准全面接轨。这一突破打破了自我保护的封闭框架,让中国临床试验数据获得国际认可——FDA对中国机构的核查中,代表临床试验无显著缺陷的“无需采取行动”(NAI)比例从2009-2015年的48.0%跃升至85.0%,超过欧美水平。
制度创新,长效监管。改革后,国家药监局建立临床试验现场核查标准,发布百余项指导原则,搭建“监管科学研究院”,授牌“现场检查实训基地”,形成以数据真实完整、保护受试者权益为核心的质量监管体系,让“诚信+科学”成为行业信仰。
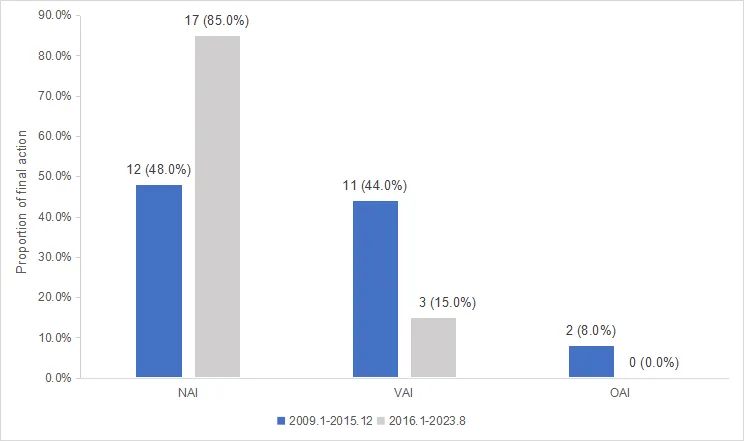
图2 2009-2015与2016-2023年国内临床试验接受FDA现场核查结果对比,“无需采取行动”(NAI)比例显著提升
➤ 成绩:十年跃迁,从跟跑到领跑
“7.22”改革以来的十年,是中国医药产业破茧成蝶的十年,交出了一份亮眼的“成绩单”:
临床试验质量跨越式提升。现场核查通过率从改革初期的不足20%升至2023年的85%,2016至2023年FDA核查中国机构结果中,零次出现OAI(严重问题,需要采取官方措施)结果,且检查结果排在前列,赶超欧美等相应发达国家。生物等效性(BE)试验数据实现国际互认“零的突破”,为创新药研发筑牢根基。
创新动能全面迸发。2015-2024年,中国自主研发创新药临床试验申请(IND)数量增长12倍,PD-1单抗、CAR-T细胞治疗等前沿领域实现全球同步研发。首个国产PD-1单抗、HPV疫苗、PARP抑制剂等标志性新药获批,让肺癌、乳腺癌等恶性肿瘤年治疗费用从30万元降至3万元以下,肝细胞癌、鼻咽癌等中国高发癌种告别“缺医少药”。
全球话语权显著提升。国产新药泽布替尼、特瑞普利单抗凭借中国临床数据获美国FDA批准,实现“中国数据、全球认可”;参与国际多中心临床试验的数量年均增长15.7%,中国已从全球药物研发的“旁观者”变为“重要参与者”。
产业生态持续优化。2024年首次获批的创新药中,国产占比达42%(2015年不足10%);生物医药领域融资额从2015年的不足百亿跃升至2023年的千亿规模,本土药企对外授权(License-out)总额突破500亿美元,资本“重仓中国Biotech”成为常态。
革新思想持续流淌。“7.22”改革不是一锤子买卖,十年来我国不断出台与时俱进、国际水平的监管举措——新药临床试验申请由“审批制”转为“备案制”、中国GCP与全球同步修订、接受境外临床试验数据、鼓励以临床价值为导向的新药研发……药政部门以被行业津津乐道的“周末作业”的方式,推出各类引领性规范和技术指导原则,推动我国医药产业蓬勃发展。
图3 2016-2023年期间FDA对中、日、韩、美、英、法各国临床试验现场核查结果比较,“无需采取行动”(NAI)比例中国仅次于日本
➤ 意义:行业发展铸就民生福祉
这场改革的深层意义,远超产业本身。
中国医药创新改革的成果举世瞩目,这不仅彰显举国体制优越性,通过“四个最严”落实和跨部门协同,短期内扭转行业积弊,印证了集中力量办大事的制度优势,同时为世界各国医药研发推动提供了可借鉴的“中国方案”。
2025年的今天,中国创新药物研发已经获得了全球的认可,十年间我们是如何重新树立中国质量的形象,靠的是全体行业从业者的努力,更是依靠我国监管领域革新过程中的公开透明与全球化视野。国家药监局在2015年相继发布多份药物临床试验数据自查报告,毫不避讳地表述了八成以上的试验可能存在各种质量问题,要求撤回补充。这种刀刃向内、自我剖析的公开透明,不但没有让中国声望扫地,反而强化了跨国企业来中国进行研发的信心。真正的改革者,是敢于直面改革中的风风雨雨,是有信心迎来风雨之后的彩虹的。
创新药物研发的行业发展,也同步推动了医学进步,惠及全民健康。新药的广泛应用让我国癌症5年生存率从2015年的40.5%升至2022年的43.7%,实打实的有利于广大人民群众。用“满足未被满足的临床需求”定义的创新药物标准,驱逐了市场上没有价值的劣币、假药,不仅促进了基础到临床的创新转化,更加推动了临床研究的创新医药学的学科发展和专职医师科学家队伍的建立,让中国正在成为比起欧美拥有更优平台和更强能力的创新国家。
作为ICH监管成员,中国已深度嵌入全球药物研发链条,既为国际药企提供高质量临床数据,也让国产创新药通过国际合作惠及全球患者。通过参加甚至主导国际多中心临床试验,提升本土药企研发水平,又助力国际新药更快进入中国市场,实现“同研同享”,在保障用药安全的同时,让全球患者共享医药创新成果。
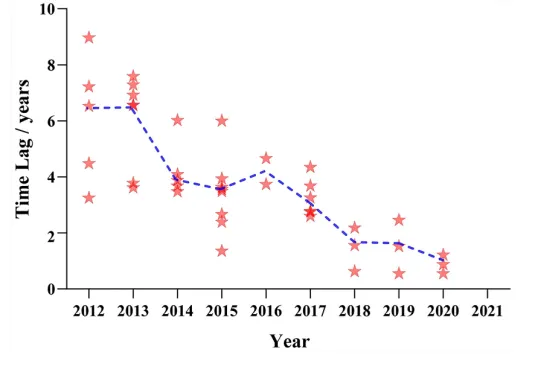
图4 2012-2020年抗肿瘤新药在中美两国获批的时间差越来越短
结语:不忘来路,再启新程
“吃水不忘挖井人”,十年前的“7·22”改革,改掉的是虚假,剜掉的是腐败,留下的是真诚,长出的是创新。从“狠抓质量、保证真实”的初心,到“十年追上人家一百年”的跨越,中国医药人用实践证明:唯有坚守科学诚信,才能赢得未来。
站在新十年的起点,我们也要心怀敬畏,十年前,由一个信念,一纸文件,通过全行业的不懈努力,把中国变成了创新的沃土。哪一天,如果我们贪恋表面的浮华,追求虚假的名望,忘记了促使我们成长的真实、质量、科学和开放,我们现在所拥有的一切也会瞬间消散。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 631
631

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 639
639

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 608
608