 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-07-25
2025-07-25
 1372
1372
Umabs DB作为目前全球最全面的抗体药物专业数据库,收录全球近10000个从临床前到商业化阶段抗体药物,涉及靶点1600+,涉及疾病种类2400+,研发机构2900+,覆盖药物蛋白序列、专利和临床等多种专业信息。Umabs DB药物数据库已正式开放上线,可访问www.umabs.com注册享受7天免费试用。
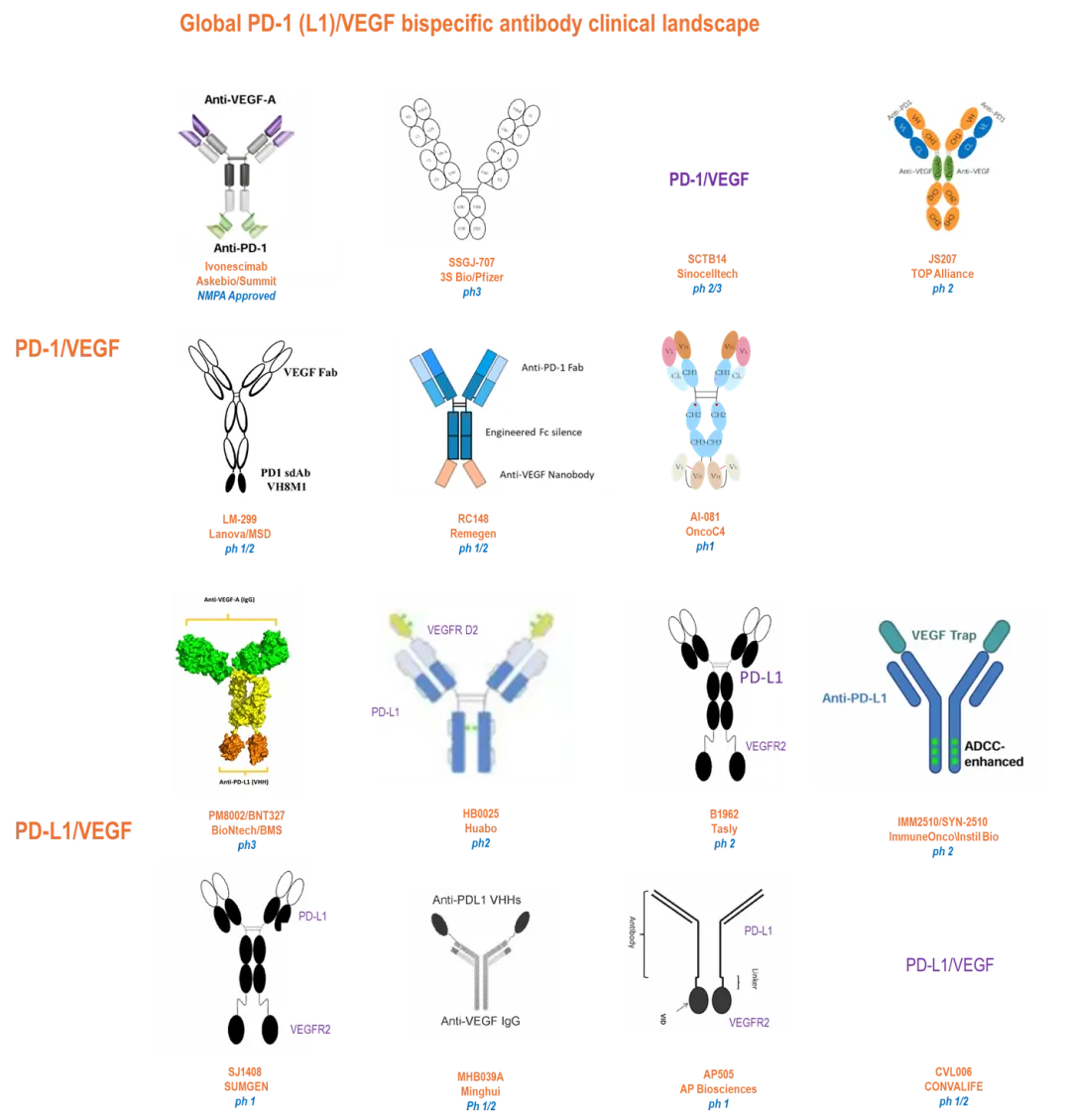
随着中国生物制药收购礼新生物(国内医药呼唤“榜一”大哥),让PD-1(L1)/VEGF双抗疗法的BD交易持续受到了关注。
当然仍然会有人持怀疑态度,当这类疗法的活跃交易持续一年后,无论是否受到裹挟,如默沙东之类的突然出手,又到退货传言,这不会是空穴来风,只能说市场变化太快。
这不前排的康方和Summit再次得到重估,新的BD机遇再次陡增,当然后排的管线同样在闪转腾挪,暗流涌动之下,下一个激点似乎随时来临。
2025年7月22日,OncoC4宣布其PD-1/VEGF 双特异性抗体AI-081,在1/2 期试验 (NCT06635785) 的 2
期部分中完成首例患者给药,有望成为潜在的同类最佳 PD-1/VEGF 双抗。

联合创始人兼首席医学官Pan Zheng提到:“ AI-081
初始剂量递增过程中表现出出色的安全性、良好的药代动力学。重要的是,在测试的最低剂量下观察到客观的抗肿瘤反应,低于其它相关疗法的相关剂量。期待在2期试验中进一步优化剂量,主要重点是非小细胞肺癌。‘’
另一方面,神州细胞的PD-1/VEGF双抗SCTB14今年以来连开两项临床,广泛布局非小细胞肺癌的一二线治疗,让其研发进度一下进入前三的行列。
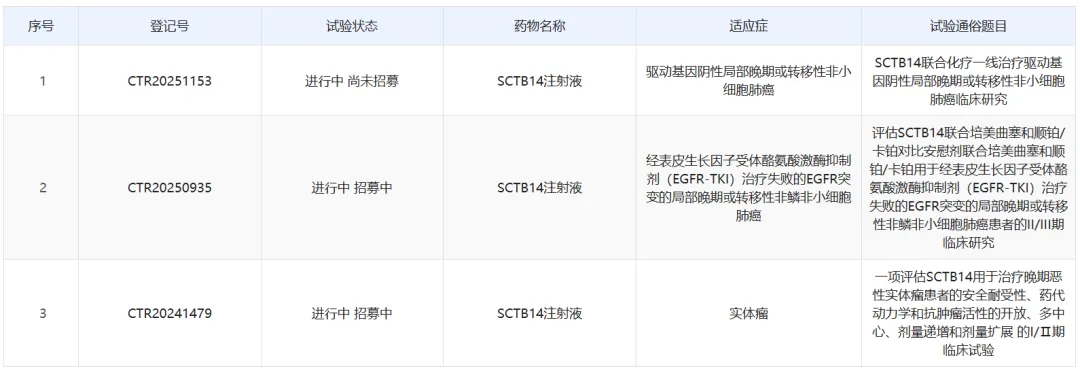
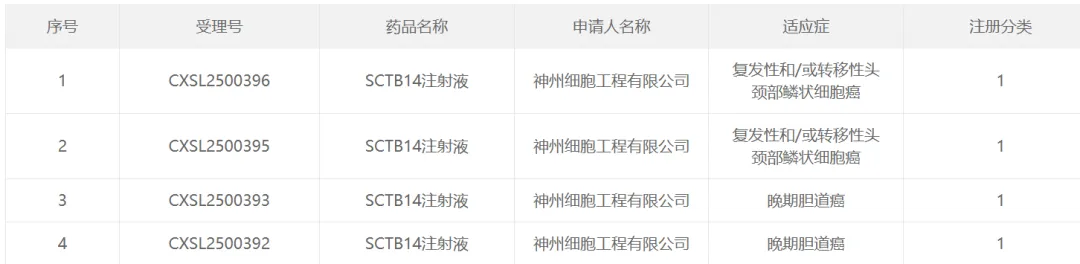
近日,其又有两项临床的试验申请得到默许,逐步拓展至头颈鳞癌和胆道癌的治疗,来势汹涌。
君实的PD-1/VEGF双抗药物同样为四价结构,但是VEGF纳米抗体包埋在PD-1抗体的铰链区中,具有显著的差异化结构,目前研发进度排在全球前四以内(康方公布PD-1/VEGF双抗机制,神药总有追随者)。
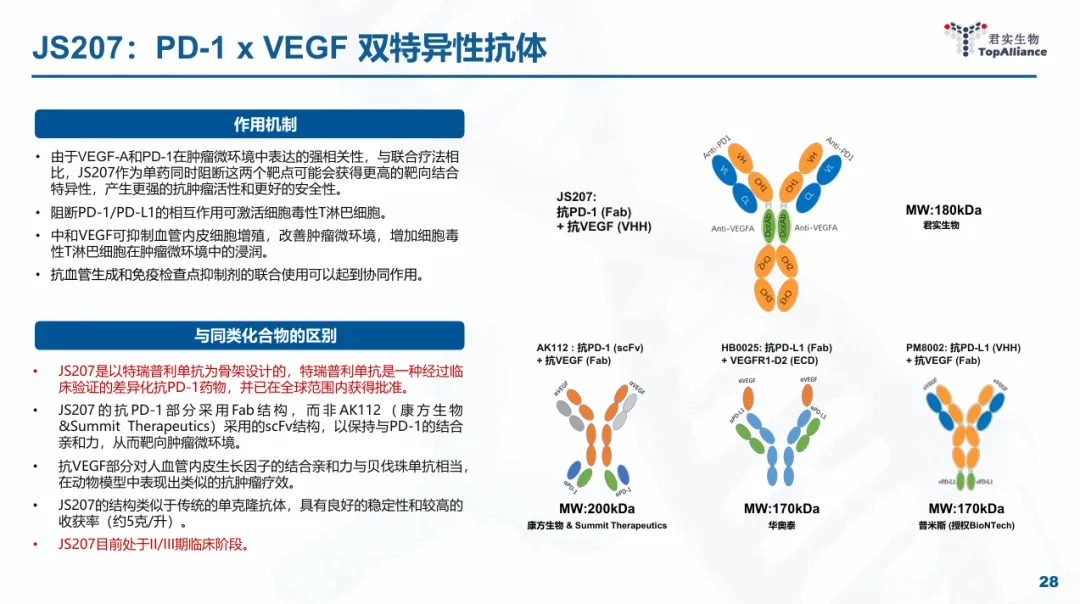
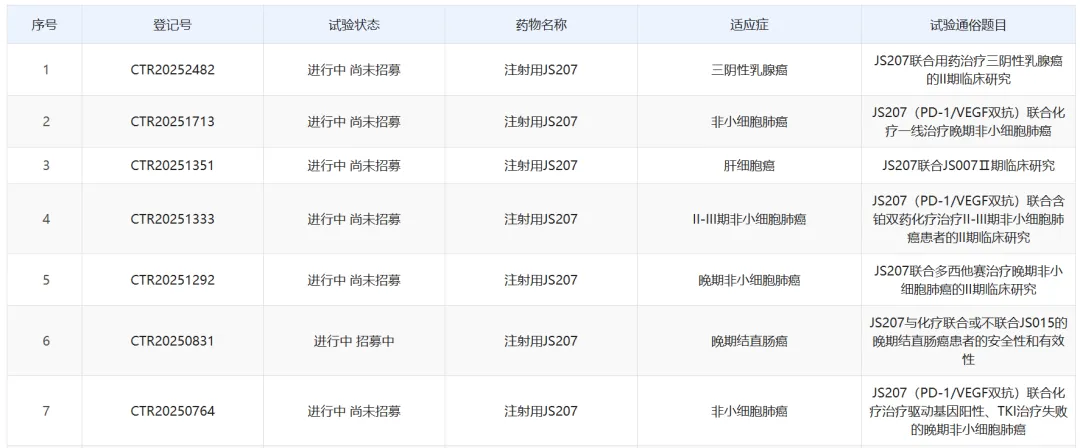
基于PD-1/VEGF疗法的全球加速,JS207在今年以来以来也加速明显,在多项实体瘤中开展了7项二期临床,甚至还其动能了一项联合Nectin-4
ADC的临床试验,但还公布任何临床数据,期待后续结果的公布。
2025年7月1日,上海华奥泰生物药业股份有限公司宣布,其自主研发的PD-L1/VEGF双特异性融合蛋白HB0025(通用名:索布瑞芙普α),联合标准治疗(SOC)用于晚期或复发的子宫内膜癌,已正式向CDE递交确证性III期临床试验启动前会议申请,其有望成为全球第四款进入三期临床的PD-1(L1)/VEGF疗法。
HB0025联合紫杉醇和卡铂用于一线治疗局部晚期、复发或转移性子宫内膜癌展现出积极疗效,其最新数据已于2025年6月在美国临床肿瘤学会年会(ASCO 2025)公布(Abstract #5602, NCT06758557):在pMMR人群中,客观缓解率(ORR)高达85.4%,显示出良好的普适疗效与人群覆盖能力。

荣昌的PD-1/VEGF疗法RC148动作稍微慢一点,今年已经启动了一项非小细胞肺癌的Ⅰb期临床研究,前天又申报了一项临床试验申请。

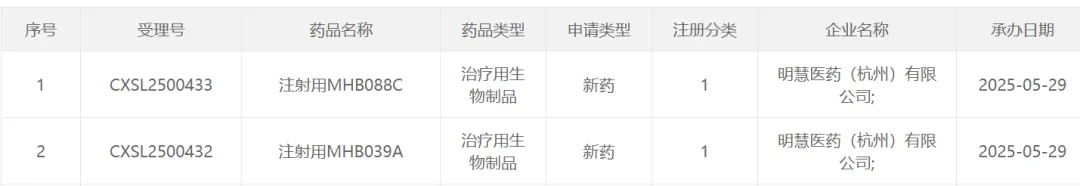
明慧生物则直接升级到联合疗法的开发,2025年5月29日,根据CDE官网公示信息,明慧医药同时递交了B7H3
ADC药物MHB088C,以及PD-L1/VEGF双抗药物的MHB039A的临床试验申请,推测应为PD-1/VEGF+ADC联用疗法申请(明慧医药递交PD-1/VEGF+ADC联用疗法申请)。
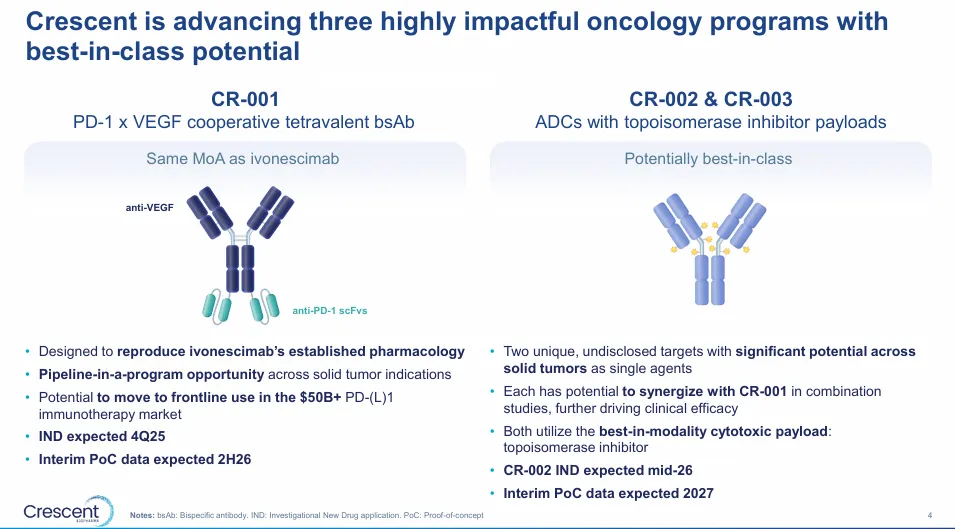
除了国内的相关的公司的在快速推动以外,海外的公司也在加速。2025 年 6 月 16 日,Crescent
Biopharma完成与GlycoMimetics的合并,并宣布完成2亿美元的私募,加速PD-1/VEGF
双特异性抗体CR-001在2026年初完成首例给药。
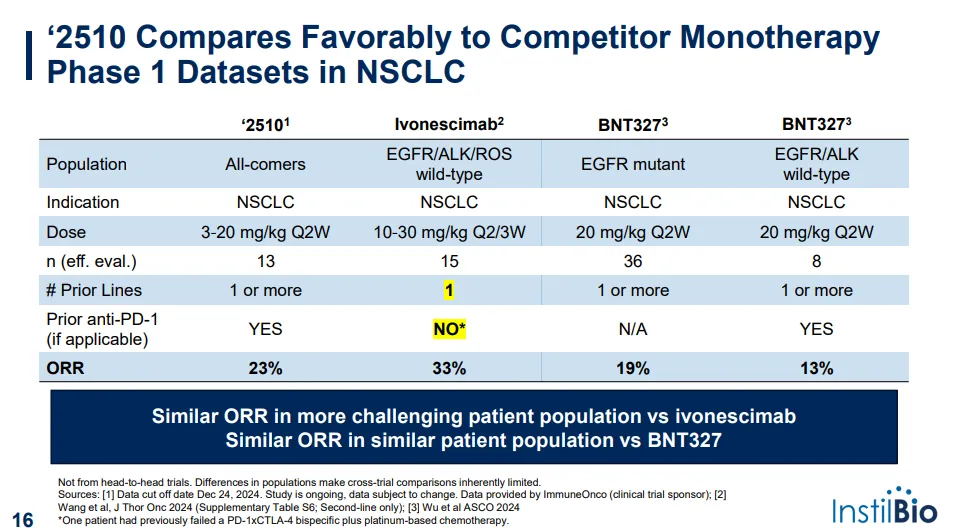
2025年7月2日,宜明昂科的海外合作伙伴instilbio宣布,已经完成PD-L1/VEGF双特异性抗体AXN-2510的IND,即将开展美国复发/难治性实体瘤的1期试验。
此前,宜明昂科已经初步公布了AXN-2510二线和一线非小细胞肺癌中的临床数据(PD-1/VEGF双抗再加速:宜明昂科公布肺癌末线数据,instilBio暴涨58%),预计2025 年下半年将分享AXN-2510+ 化疗治疗 一线非小细胞肺癌的 2 期试验的初步安全性和有效性结果。
不仅仅PD-1(L1)/VEGF双抗疗法在整体加速,甚至三抗疗法也在呼之欲出(不断升级:PD-1/VEGF三抗疗法呼之欲出)。
2025年7月7日,基石医药宣布PD-L1/VEGF/CTLA-4三抗药物CS2009,全球多中心I/II期临床研究正在澳大利亚和中国积极招募患者,并计划扩展至美国进行II期入组。

特别是在研究者及患者强烈兴趣的加持下,试验入组非常迅速,预计年底前患者数将突破100例。Ia期剂量递增研究已在多线经治的晚期实体瘤患者中完成了四个剂量水平的评估。第四剂量水平(20毫克/千克,每三周给药一次)经安全性监测委员会(SMC)评估未发生剂量限制性毒性(DLT)。
研究当前正在第五剂量水平(30毫克/千克,每三周给药一次)入组患者,主要目的为观测CS2009在潜在II期推荐剂量(RP2D)之上的安全性以及拓宽其安全性边界;同步持续回填前期剂量组(1至20毫克/千克,每三周给药一次)。Ib期/II期剂量扩展研究/关键延展研究预计将于2025年下半年启动。
此前笔者就已经预测,对于康方生物为代表开发的PD-1/VEGF双抗疗法AK112,其将科学和商业化层面带来现象级的效应,对于整个PD-1(L1)/VEGF疗法或许才刚刚开始,激流正在涌动。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 46
46

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 41
41

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 39
39