 研发追踪
研发追踪
 医麦创新药
医麦创新药  2025-07-28
2025-07-28
 1430
1430
当地时间 7 月 23 日,Avidity Biosciences(简称 Avidity)宣布,其用于治疗杜氏肌营养不良(DMD)的在研疗法 delpacibart zotadirsen(del-zota)获得美国 FDA 授予的突破性疗法资格认定,用于治疗适用于外显子 44 跳跃治疗的杜氏肌营养不良症(DMD44)患者。
值得一提的是,该疗法目前正在进行 2 期 EXPLORE44 开放标签延伸试验(EXPLORE44-OLE)。Avidity 预计将在 2025 年底按计划向 FDA 提交生物制品许可申请(BLA)。
DMD 是一种致命的罕见肌肉萎缩疾病,其致病机制在于编码抗肌萎缩蛋白(dystrophin)的基因发生变异,导致进行性肌肉萎缩和功能丧失。流行病学数据显示,全球每年新增确诊 DMD 患儿约 2 万名。若不有效干预,患者通常在 10-12 岁左右开始依赖轮椅,预期寿命很少超过 40 岁。
Del-zota 是一款抗体偶联寡核苷酸(AOC),由靶向 1 型转铁蛋白受体(TfR1)的单克隆抗体和促进编码抗肌萎缩蛋白的 mRNA 前体产生外显子 44 跳跃的寡核苷酸偶联而成,TfR1 在肌肉组织中高度表达。
这款疗法通过改变 mRNA 剪接过程,产生几乎与正常抗肌萎缩蛋白功能相同的蛋白。靶向 TfR1 的单克隆抗体可以通过与肌肉细胞表面的受体相结合,增强寡核苷酸的肌肉特异性递送。

之前 1/2 期 EXPLORE44 临床试验中展现出「史无前例」的抗肌萎缩蛋白表达能力。剂量为 5 mg/kg 和 10 mg/kg 的
del-zota 均表现出强有力的骨骼肌递送能力,骨骼肌中寡核苷酸水平达到 200 nM。外显子 44 跳跃效率显著增加
40%。抗肌萎缩蛋白生成显著增加,平均增加至正常水平的 25%,最高达到正常水平的 58%。肌酸激酶水平下降至接近正常水平,相比基线减少了超过
80%。基于上述结果,该公司计划在 2025 年底提交 BLA。
Avidity 还计划在 2025 年第四季度公布正在进行的、已完全入组的 2 期试验 EXPLORE44-OLE 的 topline 数据和功能数据。
除获突破性突破性疗法资格,del-zota 此前已获得 FDA 和欧洲药品管理局(EMA)的孤儿药资格认定,以及 FDA 针对 DMD44 治疗的罕见儿科疾病资格认定和快速通道资格认定。
Avidity 为 AOC 领域的先驱,已有 3 款 AOC 疗法推进到关键注册临床试验。del-zota 的预期上市将为该公司其他神经肌肉疾病项目(用于 1 型强直性肌营养不良症的 del-desiran 和用于面肩肱型肌营养不良症的 del-brax)的潜在后续上市奠定基础。
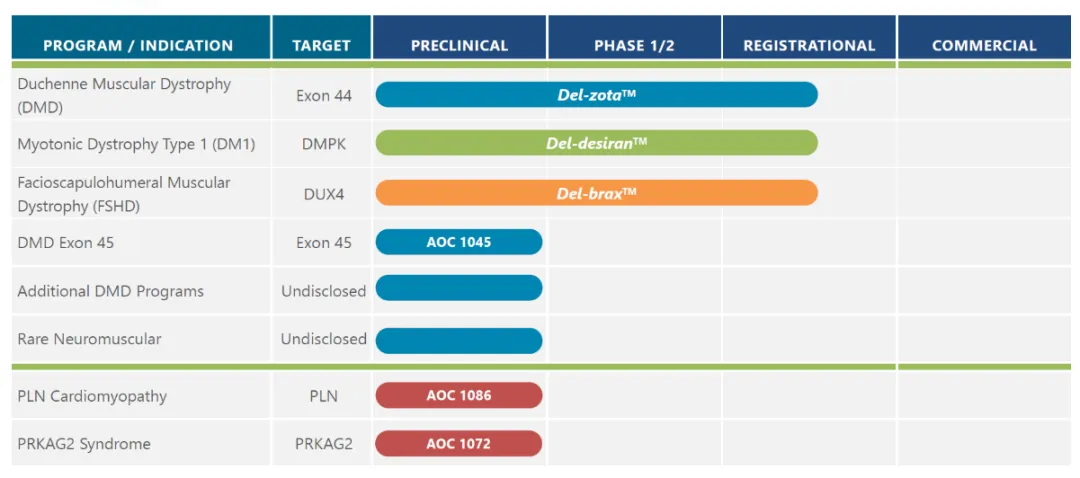
▲ 截图来源:Avidity 官网
原文链接:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 46
46

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 41
41

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 39
39