 研发追踪
研发追踪
 生物药大时代
生物药大时代  2025-07-25
2025-07-25
 1560
1560
近日,健康元(600380)发布公告,控股子公司丽珠集团(000513)控股附属公司珠海市丽珠单抗生物技术有限公司与北京鑫康合生物医药科技有限公司联合开发的IL-17A/F单抗药物LZM012(XKH004)在针对银屑病适应症的Ⅲ期头对头临床研究中达到主要研究终点。
至此,作为国内自主创新开发的首款IL-17A/F单抗药物,LZM012开展的两个适应症临床Ⅲ期研究均达到主要终点。

LZM012(XKH004)由丽珠单抗与鑫康合生物联合开发,丽珠单抗已获得该产品在全球范围内的开发、注册、生产、销售和分许可的独占性权益。
据丽珠新闻稿,这是中国首个、全球范围内第二个完成III期临床试验的IL-17A/F双靶点抑制剂,LZM012在本项研究中直接采用头对头研究设计,对标司库奇尤单抗。司库奇尤单抗是全球首款获批上市的IL-17A单抗,其2024年全球销售额为61.41亿美元。
该Ⅲ期临床研究是一项在中重度斑块型银屑病患者中开展的多中心、随机、双盲、阳性对照(司库奇尤单抗)的临床试验。临床试验组长单位为复旦大学附属华山医院。该III期临床试验以第12周时达到银屑病面积与严重程度指数(PASI)100的受试者比例(PASI100应答率)为主要评价终点。
研究结果显示:
该研究的主要疗效终点已达到。第12周 PASI 100应答率,LZM012 为 49.5%,对照组司库奇尤单抗为40.2%,显示出 LZM012 非劣效于司库奇尤单抗且优效于司库奇尤单抗。
主要的次要疗效终点,第 4 周 PASI 75 应答率,LZM012 为 65.7%,对照组司库奇尤单抗为 50.3%,显示出 LZM012 起效速度更快;第 52 周 PASI 100 应答率,LZM012 320mg Q4W 和 320mg Q8W 维持治疗组分别为 75.9%和 62.6%, 显示银屑病患者可持续提升获益。
安全性方面,本品整体安全性良好,常见不良事件发生率与对照组各类不良事件发生率相当。
IL-17A和IL-17F都是促发银屑病炎症的重要细胞因子,LZM012把“瞄准镜”同时对准 IL-17A 与 IL-17F 两个靶点,而司库奇尤单抗只锁定 IL-17A。相较于单靶药物,双靶药物理论上能把炎症压制得更干净。正如UCB公司已获批上市的IL-17A/F 双抗比奇珠单抗在头对头研究中力压司库奇尤单抗,上市即放量—2023 年全球销售额1.48亿欧元,2024 年跃升至逾 6亿欧元。
基于此,丽珠集团近期已就 LZM012 治疗成人中重度斑块状银屑病适应症,向国家药品监督管理局药品审评中心(CDE)递交上市许可申请前的沟通交流申请,推进 LZM012 的上市进程。
总结
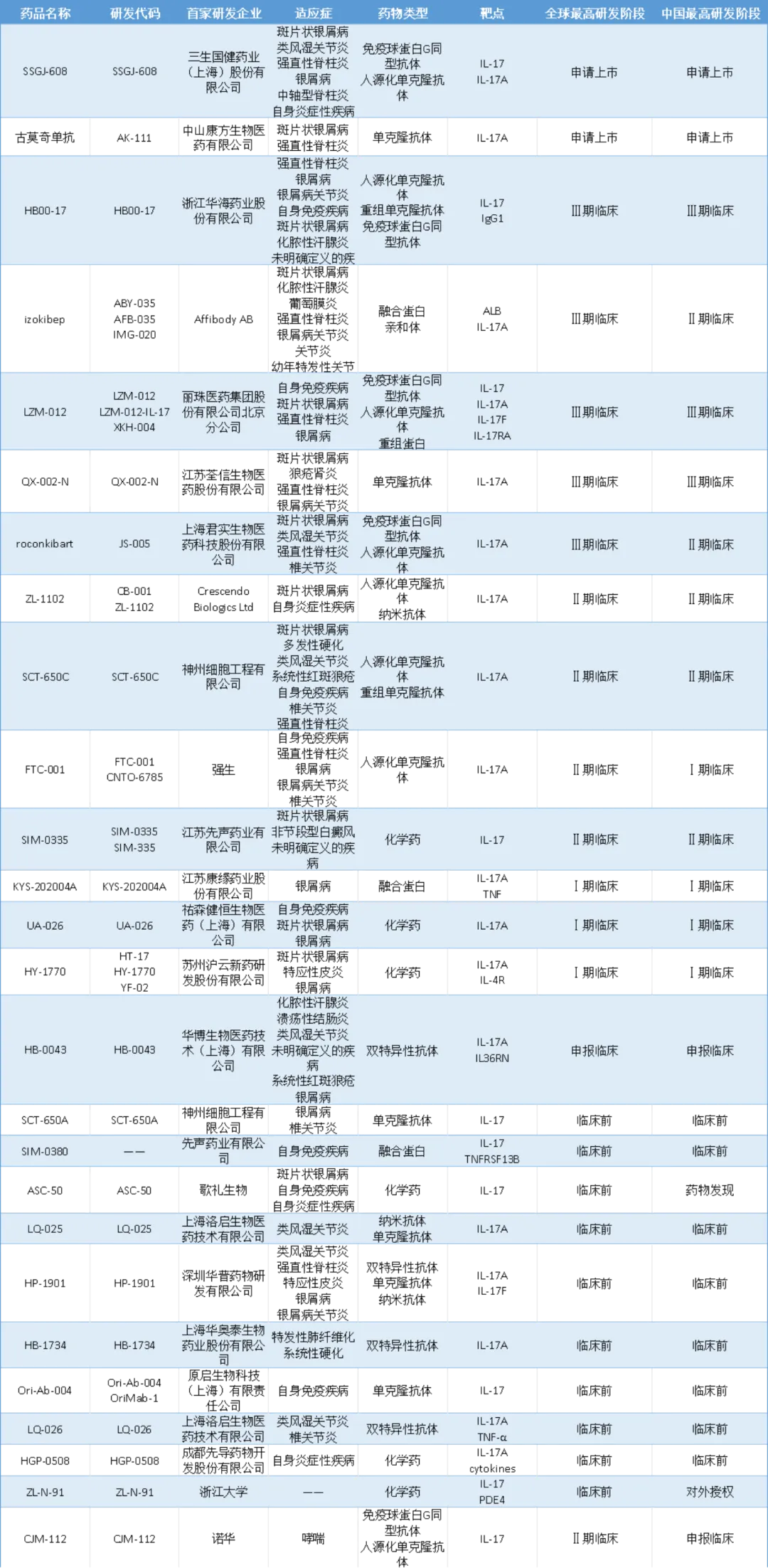
目前,全球共6款IL-17靶向药物获批上市,分别为赛立奇单抗(智翔金泰)、夫那奇珠单抗(恒瑞医药)、比奇珠单抗(UCB)、netakimab(Biocad/上药博康)、依奇珠单抗(礼来)和司库奇尤单抗(诺华),其中仅比奇珠单抗为IL-17A/IL-17F单抗,其余5款均为IL-17A单抗。

SSGJ-608(三生国健)、古莫奇单抗(康方生物)也已申报上市。根据摩熵医药数据,目前国内还有24款IL-17靶点创新药物在研,这些在研品种覆盖了IL-17A、IL-17A/F、IL-17RA等多个亚型,涉及单抗、双抗、融合蛋白等多种分子形式,适应症主要集中在银屑病、强直性脊柱炎、银屑病关节炎等自免炎症领域。从企业布局来看,荃信生物、君实生物等本土创新药企已进入临床III期阶段。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 46
46

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 41
41

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 39
39