 研发追踪
研发追踪
 药时空
药时空  2025-11-24
2025-11-24
 549
549
11月19日,美国食品药品监督管理局(FDA)宣布加速批准拜耳的小分子疗法Hyrnuo(sevabertinib),用于治疗经FDA批准的检测方法确认存在HER2(ERBB2)酪氨酸激酶结构域(TKD)激活突变、且已接受过至少一种全身治疗的成人局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者。
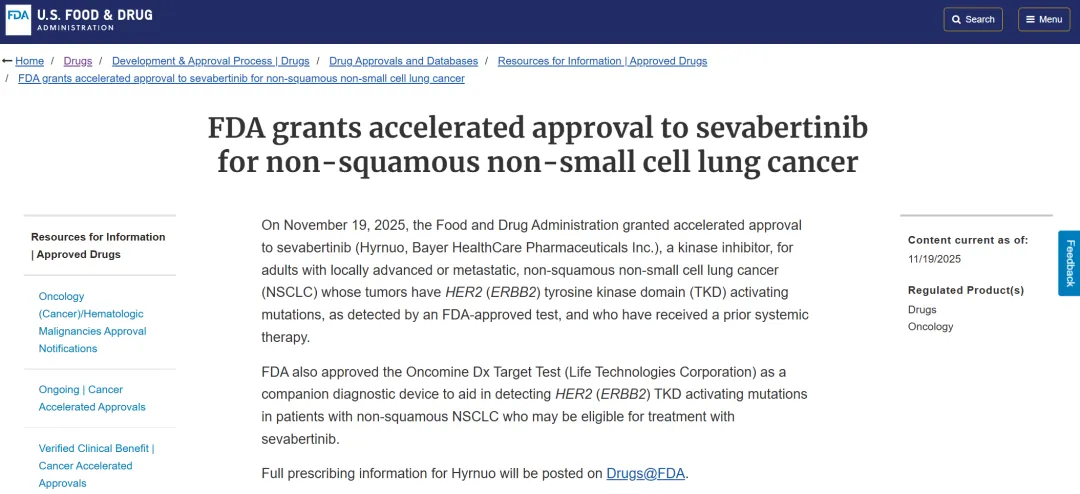
Hyrnuo是一种酪氨酸激酶抑制剂(TKI),是一种每日两次口服药物。此次通过FDA的加速批准通道获得了批准,意味着其仍需在一项验证性研究中证明其价值。尽管如此,FDA在拜耳的1/2期Soho-01试验中看到了初步的临床益处证据。
根据FDA的数据,在这项开放标签研究中,70名之前接受过系统治疗但未接受过专门针对HER2突变的治疗的患者中,客观缓解率为71%。在该组中,缓解持续时间中位数为9.2个月,超过一半(54%)的患者缓解持续时间至少为6个月。
对于研究中52名之前接受过HER2靶向抗体药物偶联物治疗的患者,客观缓解率为38%。该队列中缓解持续时间的中位数为7个月,60%的患者缓解持续时间至少为6个月。
公司研发负责人Christian Rommel博士在媒体声明中表示,拜耳估计,每年有多达8.4万人被诊断出患有携带HER2突变的NSCLC。此外,拜耳美国精准肿瘤品牌负责人Chandrasekhar Goda在声明中补充表示,Hyrnuo的加速批准“反映了这种疗法在美国为携带HER2突变的晚期NSCLC患者推进治疗范式的重大潜力”。
值得注意的是,就在几个月前,其竞争对手勃林格殷格翰已经凭借首个能够靶向非小细胞肺癌(NSCLC)患者中罕见肿瘤类型的药物进入肿瘤学领域。目前,这一治疗领域由勃林格殷格翰及其TKI药物Hernexeos占据,后者于今年8月,抢先一步获美国FDA加速批准,用于经FDA批准检测证实肿瘤存在HER2(ERBB2)酪氨酸激酶结构域(TKD)激活突变、且接受过全身治疗的不可切除或转移性非鳞状非小细胞肺癌(NSCLC)成人患者,其既是首个口服HER2肺癌靶向药,也是全球首个针对该突变类型的口服小分子抑制剂。
研究数据显示,在勃林格殷格翰的Lung-1 1b期试验中,Hernexeos在71名之前接受过铂类化疗但未接受过HER2靶向TKI或ADC的患者中,客观缓解率为75%,其中58%的患者缓解持续时间至少为6个月。
尽管这两种药物都靶向相同的突变肿瘤,但拜耳的药物专门用于局部晚期或转移性非鳞状NSCLC,而勃林格殷格翰的药物的适用标签与之有些小差异,其适用于不可切除或转移性癌症。
总之,这两家公司都在寻求在一线治疗环境中扩大患者群体。上个月在欧洲医学肿瘤学会大会上,两家公司都展示了其各自产品的积极数据,结果大致相似,勃林格殷格翰报告其在初治患者的治疗研究中客观缓解率为77%,拜耳在同一人群中读出的结果为71%。
不过,勃林格殷格翰存在先发优势,其药物Hernexeos已经抢先在一线治疗环境中获得了FDA突破性疗法认定。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 19
19

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 17
17

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 17
17