 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-08-02
2025-08-02
 1282
1282
7月最后一天,5家Biotech集体向港股18A和科创板第五套发起冲击。
港股方面,银诺医药打头阵通过聆讯,即将加入港股上市大军;丹诺医药和旺山旺水新增递表。另一边,泰诺麦博以第五套上市的申请已获得受理,艺妙神州也剑指科创板,开启了上市辅导。
据医药魔方InvestGo数据库,今年以来,22家医疗健康企业IPO,其中8家包括创新药企,融资金额达137.9亿元,数量已超过2024年全年水平,融资总额已超过2023年水平。
目前来看,港股市场生物医药企业IPO热度持续,科创板第五套也进一步释放出积极信号,企业信心有所恢复。这都预示着,下半年,生物医药企业的IPO复苏潮仍将持续。
港股18A:1家过聆讯,2家递表
7月31日,港交所官网显示,广州银诺医药集团股份有限公司(以下简称:银诺医药)过聆讯,即将在港上市。中信证券、中金公司为联席保荐人。
银诺医药成立于2014年,以发现、开发及商业化糖尿病及其他代谢性疾病的创新疗法为核心业务模式,并已建立针对糖尿病和其他代谢性疾病的候选药物管线。
其管线目前包括正在开发用于治疗肥胖和超重及代谢功能障碍相关性脂肪性肝炎(MASH)的核心产品依苏帕格鲁肽a,以及五款处于临床前阶段的候选药物。

银诺医药管线图;来源:招股书
招股书显示,银诺医药核心产品依苏帕格鲁肽a是一款在中国获批的人源长效GLP-1受体激动剂,用于治疗2型糖尿病(T2D)。
此外,依苏帕格鲁肽a正在进行用于治疗肥胖和超重的核心产品IIb/III期临床试验,预计将于2026年第四季度完成。其用于治疗MASH管线已获得FDA和NMPA的IND批准,尚未开始该适应症的临床试验。
除了依苏帕格鲁肽a之外,银诺医药还正在开发处于临床前阶段和进入IND准备阶段的候选药物,如用于治疗阿尔茨海默病(AD)的YN014、用于治疗1型糖尿病的YN401、用于治疗MASH的YN209、用于治疗2型糖尿病的YN203、用于治疗肥胖和超重的YN202等。
财务方面,银诺医药于2025年2月在中国商业化推出了用于治疗T2D的依苏帕格鲁肽a。截至2025年5月31日,其在中国销售依苏帕格鲁肽a产生收入人民币38.1百万元。
其净亏损由截至2024年5月31日止五个月的人民币61.9百万元增加至截至2025年5月31日止五个月的人民币97.9百万元,主要由于商业化依苏帕格鲁肽a后开展了相关销售及促销活动及研发开支增加。该亏损增加部分被在中国销售依苏帕格鲁肽α的毛利增加所抵销。
作为一家生物科技公司,银诺医药在未能符合港股上市规则第8.05(1)、(2)或(3)条规定的情况下,根据上市规则第十八A章寻求在联交所主板上市,其核心产品为符合上市规则第十八A章及新上市申请人指南第2.3章项下合资格规定的产品。
港股近半年来十分火爆,选择在港股上市的生物医药公司络绎不绝。除了刚刚过聆讯的银诺医药外,苏州旺山旺水生物医药股份有限公司(以下简称“旺山旺水”)和丹诺医药(苏州)股份有限公司(以下简称“丹诺医药”)也在近两日在港股递交了招股书。
成立于2013年的旺山旺水是一家生物医药公司,从事发现、获取、开发和商业化小分子药物。
旺山旺水主要聚焦于三个治疗领域:病毒感染、神经精神及生殖质健康,还开发了由九款创新资产(包括两款核心产品LV232、TPN171以及一款关键产品WV116)组成的管线。
招股书显示,LV232是一款潜在的同类首创双靶点5-羟色胺转运体(「5-HTT」)/5-羟色胺3(「5-HT,」)受体调节剂,目前正准备进行治疗抑郁症的I期临床试验。
TPN171是一款潜在同类最佳、高效及高选择性的磷酸二酯酶5(PDE5)抑制剂,已于乌兹别克斯坦及中国获批用于治疗勃起功能障碍(ED)。
W116为依赖于RNA的RNA聚合酶(RdRp)抑制剂,其已在中国和乌兹别克斯坦获批准用于治疗COVID-19,商品名分别为民得维®及MINDVY@,且目前在中国处于治疗呼吸道合胞病毒(RSV)感染的II/III期临床开发。
财务方面,旺山旺水于2024年录得年内净亏损人民币217.6百万元,于2023年录得年内净利润人民币6.4百万元。该波动主要是由于其收入有所下降,从2023年的人民币199.7 百万元大幅降至2024年的人民币11.8百万元,主要归因于对外许可收入大幅减少人民币191.1百万元。
于2025年首四个月,其录得净亏损人民币112.4百万元,在2024年首四个月,其录得净亏损人民币73.8百万元。这一波动主要是由行政开支大幅增加人民币31.7百万元,主要与其在2025年采用的新限制性股份计划有关。
同样作为一家生物科技公司,因未能满足港股上市规则第8.05(1)、(2)或(3)条规定的情况,故旺山旺水根据上市规则第十八A章寻求在联交所主板上市,其核心产品是旨在符合《上市规则》第18A 章及《新上市申请人指南》第2.3章下资格规定的产品。
而丹诺医药亦是如此,选择以港股18A为上市通道。
成立于2013年的丹诺医药是一家临近商业化阶段的生物科技公司,专注于发现、开发及商业化差异化的创新药产品,以解决细菌感染及细菌代谢相关疾病领域的未被满足临床需求。
招股书显示,丹诺医药已建立一条由七项创新资产组成的差异化管线,包括三项核心产品:
即利福特尼唑(TNP-2198),是全球首个且唯一治疗幽门螺杆菌感染的新分子实体(「NME」)候选药物;
利福喹酮(TNP-2092)注射剂,一款潜在首创三靶点治疗植入体相关细菌感染的候选药物;
TNP-2092口服制剂,全球首个用于治疗肠道菌群代谢相关疾病的多靶点候选药物。
财务方面,丹诺医药于2023年及2024年以及截至2024年及2025年3月31日止三个月分别录得净亏损人民币191.8百万元、人民币145.9百万元、人民币27.9百万元及人民币38.0百万元,主要由于往绩记录期间产生大量的研发开支。
可以看到的是,生物医药上市潮不仅在港股掀起,也同样呈现在科创板。
两家创新药企试水科创板第五套
继禾元生物和北芯生命成功过会后,科创板在第五套迎来重启后首家“正统”的创新药企。
7月31日,珠海泰诺麦博制药股份有限公司(以下简称:泰诺麦博)以科创板第五套上市的申请获得上交所受理。
招股书显示,泰诺麦博致力于全人源单抗新药的开发、制造、商业化及全球特异性血液制品的潜在替代。
凭借自主开发的“高通量全人源单克隆抗体研发综合技术平台HitmAb®”等技术平台,泰诺麦博已开发出多个抗体药物及候选药物抗体分子,目前有两款核心产品:
(i)斯泰度塔单抗注射液(TNM002,商品名:新替妥®),已于2025年2月在中国获批上市,这是抗感染领域首个被CDE认定为突破性治疗药物的国产创新生物药,也获得了FDA“快速通道(Fast Track)”资格;
(ii)TNM001(抗呼吸道合胞病毒RSV单抗),目前是全球第三、我国首款适用于健康及高危婴幼儿的预防用长效抗RSV单抗药物,正在进行临床III期试验。
其他产品包括:TNM009(抗神经生长因子NGF单抗)、TNM005(抗水痘-带状疱疹病毒VZV单抗)已完成临床I期试验;TNM006(抗人巨细胞病毒HCMV单抗)已获批IND,另有3 款候选药物处于临床前阶段。
泰诺麦博称,斯泰度塔单抗注射液和TNM005为全球同类首创(First-in-Class),TNM001和TNM006具有国产首款潜力。
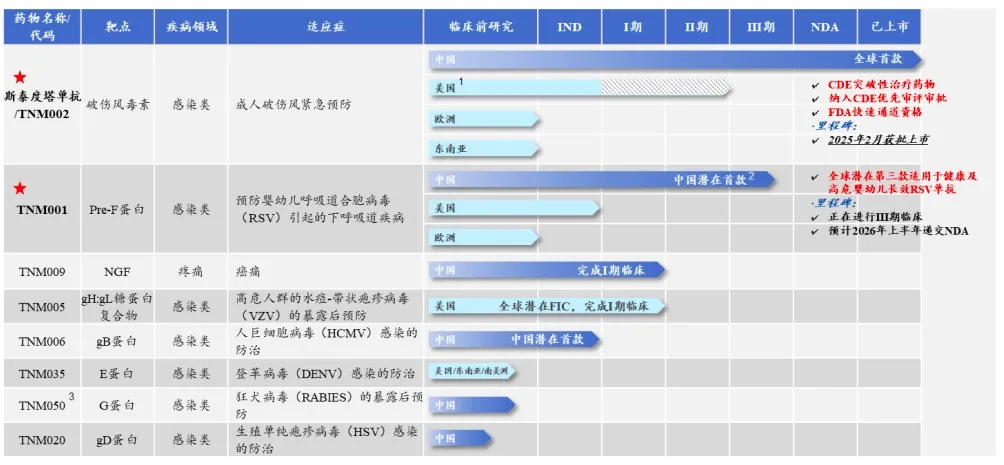
泰诺麦博在研管线图;来源:招股书
2022年至2024年,泰诺麦博主要产品尚未上市销售,收入均来自向百克生物的专利技术转让收入,分别亏损4.29亿元、4.46亿元、5.15亿元。2025年3月,泰诺麦博开始销售斯泰度塔单抗注射液,1-3月的报告期内共实现药品销售收入16.93万元,亏损1.77亿元。
招股书显示,泰诺麦博完成了多轮股权转让和增资。截至目前,持有5%以上股份的股东有康哲创投、格金八号、新动力,以及康君投资(通过旗下康君仲元、康君承季和宁波康凯)。
此次上市,泰诺麦博计划募资15亿元,其中8.3亿元投向新药研发,3.3亿元用于抗体生产基地扩建,新增建设原液及预充针剂型制剂车间,并引入先进的生产设备,满足其临床及商业化阶段的抗体原液及新型制剂生产需求;3.4亿元用作补充营运资金。
而随着科创板第五套重启的信号逐步明确,更多Biotech开始向科创板发起冲击。
近日,北京艺妙神州生物医药股份有限公司(以下简称:艺妙神州)进行了科创板上市辅导备案。
艺妙神州成立于2015年,致力于研发恶性肿瘤治疗的基因细胞药物,拥有一站式基因细胞药物技术和产业化平台,掌握CAR-T药物全流程生产制备的核心技术,已获批7项CAR-T细胞一类新药IND批件和北京首张基因细胞药品生产许可证,核心研发管线覆盖淋巴瘤、白血病、骨髓瘤等血液肿瘤和肝癌、结直肠癌等实体肿瘤以及系统性红斑狼疮等自身免疫疾病。
艺妙神州目前进展最快的产品是其靶向CD19的自体CAR-T细胞候选产品IM19,其用于治疗复发或难治弥漫大B细胞淋巴瘤(r/r DLBCL)适应症的NDA已于2024年11月获得受理,获批上市后有望填补国产自主CAR-T药物在淋巴瘤适应症领域的市场空白。
医药魔方InvestGo数据库显示,从2015年至2025年,艺妙神州完成了10轮融资。
2025年1月,艺妙神州完成数亿元E轮融资,由京津冀协同发展产业投资基金领投,太平医疗健康基金、首发展集团、四季青投资、阳光诺和等跟投。这一轮融资将用于IM19的商业化布局,以及打造快速CAR-T、通用型CAR-T、基因编辑等下一代基因细胞药物技术平台,以及推进行业领先的规模化GMP生产制造基地建设落地。

 产业资讯
产业资讯
 新药猎人笔记
新药猎人笔记  2025-11-24
2025-11-24
 104
104

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2025-11-24
2025-11-24
 94
94

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-11-24
2025-11-24
 97
97