 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-08-06
2025-08-06
 2055
2055
Umabs DB作为目前全球最全面的抗体药物专业数据库,收录全球近10000个从临床前到商业化阶段抗体药物,涉及靶点1600+,涉及疾病种类2400+,研发机构2900+,覆盖药物蛋白序列、专利和临床等多种专业信息。Umabs DB药物数据库已正式开放上线,可访问www.umabs.com注册享受7天免费试用。
2025年8月4日,根据CDE官网公示,宜联生物递交的一项B7H3 ADC药物YL201,联合康方生物的PD-1/VEGF双抗依沃西用于多种实体瘤的临床试验申请得到批准,这也是康方生物的PD-1/VEGF双抗依沃西启动的首个联合ADC临床(肿瘤药物的关键时刻:“IO+ADC”2.0)。
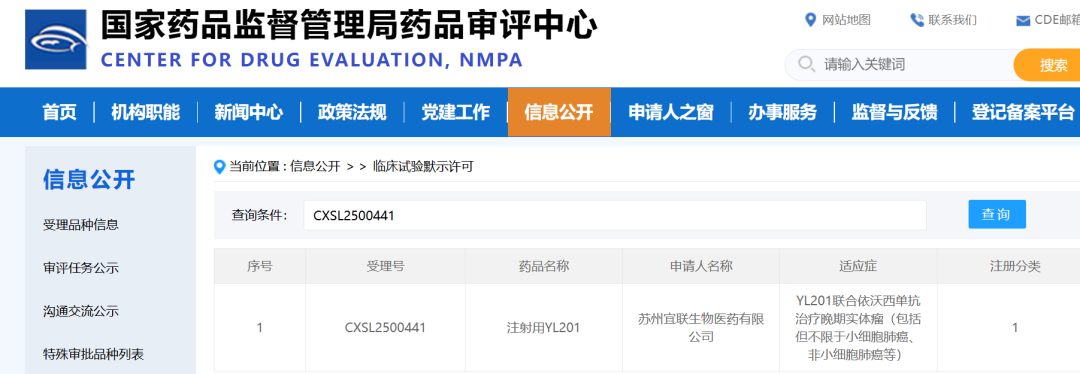
上个月康方的首款双抗ADC药物AK146D1完成首例给药后(康方TROP-2/Nectin-4双抗ADC启动澳洲一期临床),提出了“IO+ADC”2.0概念,但是基于内部ADC药物项目研发还处于早期,首个和D-1/VEGF双抗依沃西为外部项目。
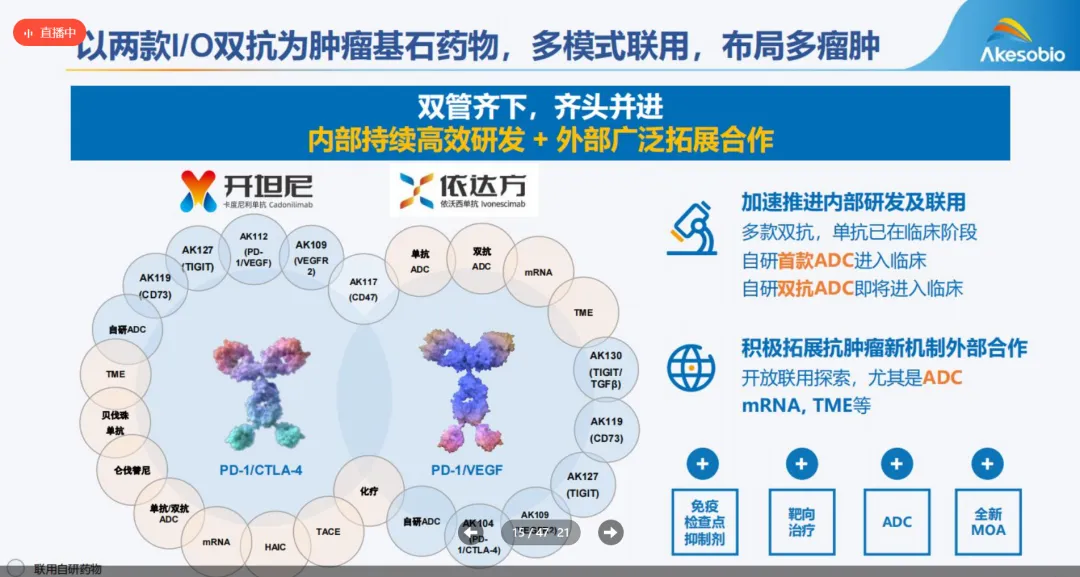
宜联生物的B7H3 ADC药物YL201已经启动两项三期临床(多箭齐发:宜联B7H3 ADC欲全覆盖小细胞肺癌),同时其HER3
ADC药物更早的时候,已经启动了和BioNtech的PD-L1/VEGF双抗联合疗法临床(PD-L1/VEGF+HER3
ADC:BioNtech再启动一项联合疗法临床)。
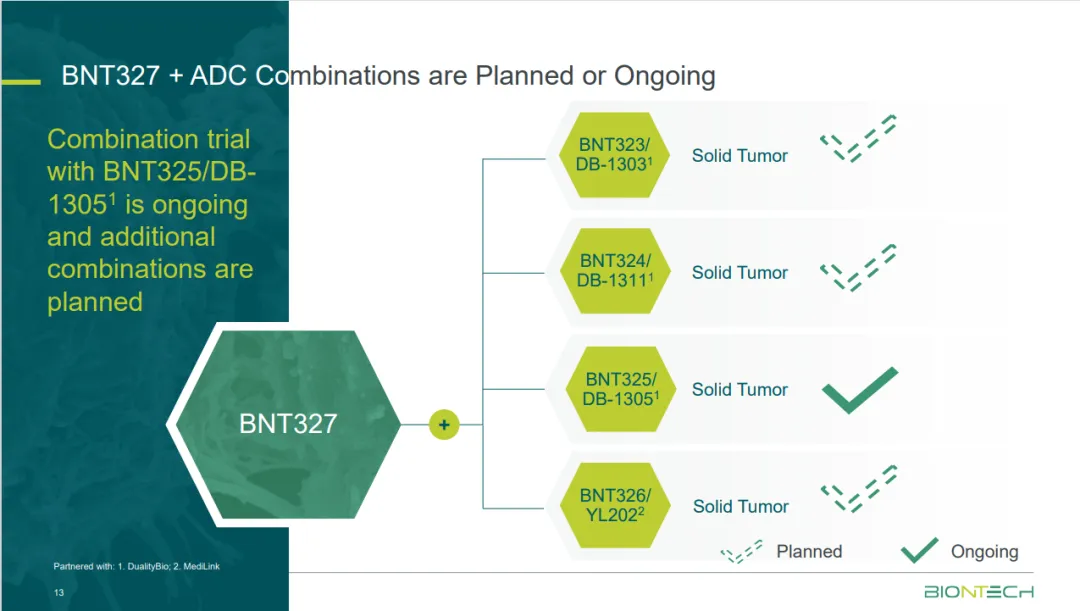
依达方®(依沃西单抗注射液)是康方生物自主研发的、全球首创PD-1/VEGF双特异性肿瘤免疫治疗药物。依达方®于2024年5月获得中国国家药品监督管理局批准上市,用于EGFR-TKI治疗进展的局部晚期或转移性nsq-NSCLC,成为全球首个获批上市的“肿瘤免疫+抗血管生成“协同抗肿瘤机制的双特异性抗体新药。
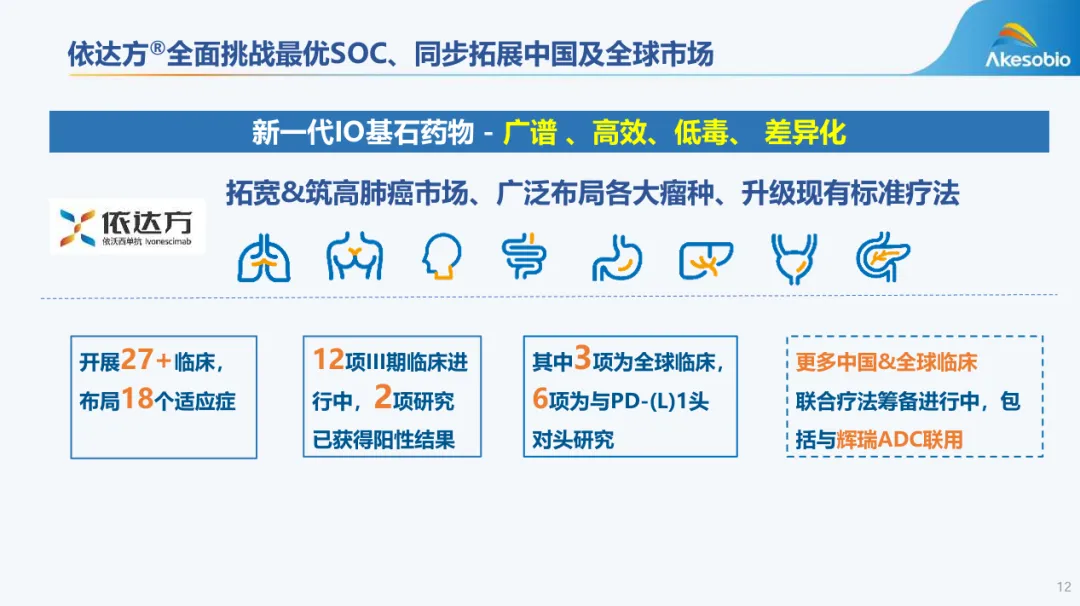
2024年11月,依达方®首个适应症被纳入2024年国家医保目录。同时依达方®单药一线治疗PD-L1表达阳性的晚期NSCLC适应症获优先审评,并于2025年4月获批上市。目前已经递交了第三项联合化疗的一线非小细胞肺癌的上市申请,未来商业化进程值得期待(康方PD-1/VEGF递交第三项上市申请)。
但是康方在双抗药物方面的研发成功,并不能掩盖其在ADC领域的启动过于缓慢,两款ADC药物还处在早期,HER3 ADC甚至还在撤回后一年重新申报临床(康方生物重新申请HER3 ADC药物IND),同时虽然临床前还有多款ADC药物在研(EGFR ADC勇求迭代),让其“IO+ADC”2.0战略内部难以落地(肿瘤药物的关键时刻:“IO+ADC”2.0),只能寻求外部合作,这和当年K要临床联用推广策略将极为相似。
值得注意的是,笔者并没有查到康方和宜联关于联合用药的合作公开信息,反倒是两年前,礼新医药一度牵手康方,共同推进AK112联合礼新医药的CLDN18.2 ADC药物LM-302的临床开发,但这项临床似乎并没有开展过,并随着礼新生物开发自主的PD-1/VEGF双抗(默沙东终于信了:5.88亿美元首付款引进礼新PD-1/VEGF双抗),这项合作就难进行下去。
期待该项临床早日传来临床捷报,更多有关抗体药物具体信息、专利及临床等动态进展,敬请关注Umabs
DB全球数据库(www.umabs.com)的更新。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 42
42

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 38
38

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 35
35