 会员动态
会员动态
 猎药人俱乐部
猎药人俱乐部  2025-08-29
2025-08-29
 777
777
8月26日,映恩生物登记开展了一项 ADAM9 ADC药物DB-1317治疗晚期/转移性实体瘤的I期临床试验。
该试验是一项名为DB-1317-101的多中心、开放标签Ia/Ib期研究,旨在评估DB-1317在特定晚期/转移性实体瘤中的疗效、安全性及药代动力学(NCT07141706)。该研究计划在2025年9月启动,预计2028年6月完成主要试验及整体研究,拟招募183名符合条件的患者,试验地点涵盖美国和澳大利亚。

从研究设计来看,试验分为Ia期(剂量递增与补充入组)和Ib期(剂量扩展)两个阶段。Ia期将评估DB-1317的5个递增剂量水平,给药周期为每3周一次(Q3W)。Ib期将在Ia期剂量递增完成并确定最大耐受剂量(MTD)或最大给药剂量(MAD)后,根据Ia期观察到的特定实体瘤初步抗肿瘤活性决定是否开启至多3个随机扩展队列,每个队列针对特定瘤种。每个队列预计招募40名患者,Ib期临床总计预计招募120例患者。
主要终点方面,Ia期阶段为:DLT患者比例、随访期间的TEAE和SAE患者比例以及MTD;Ib期阶段为推荐剂量(RP2D)、随访期间的TEAE和SAE患者比例以及ORR、DoR、DCR和TTR.
作为DB-1317首次开启的一项针对晚期/转移性实体瘤的临床试验,该研究成果有望为胃癌、结直肠癌、胰腺导管腺癌等难治性实体瘤的治疗提供新的方向,尤其在 ADAM9 靶向治疗领域具有重要探索意义,为后续进一步的临床研究和药物研发奠定基础。
关于DB-1317和ADAM9 ADC
DB-1317是映恩半年报披露的一条新管线,是一款靶向ADAM9的ADC药物。根据映恩生物半年度业绩会信息,DB-1317可能沿用HER2 ADC DB-1303的相关技术,且在胃肠道肿瘤领域的临床前数据较好。
目前ADAM9 ADC在研药物共有5款,除了DB-1317之外还有MacroGenics的MGC028处于临床I期阶段、百济神州的ADAM9 ADC处于申请临床阶段、映恩生物另外一款药物处于临床前阶段、以及已经停止开发且曾饱受争议的IMGC936。
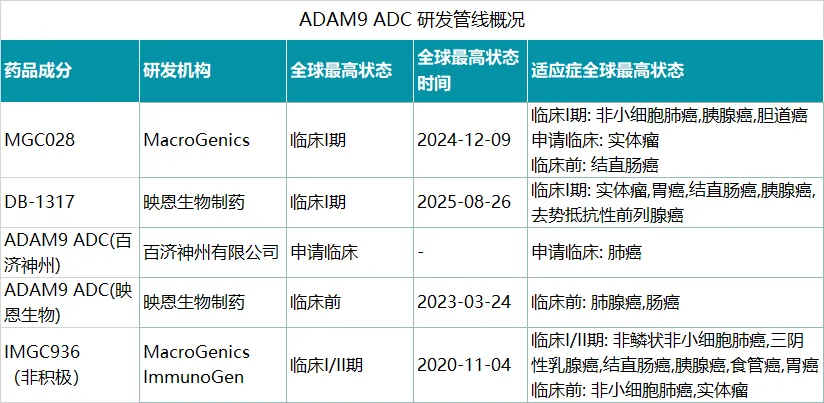
2024年3月,艾伯维AbbVie宣布将终止与MacroGenics合作开发IMGC936,原因是其临床I期试验结果没有达到预期内的安全性和有效性目标。IMGC936此前由ImmunoGen和MacroGenics合作开发,后AbbVie以101亿美元的价格收购了ImmunoGen。
尽管IMGC936的临床开发终止了,但对于ADAM9 ADC药物的开发MacroGenics并没有放弃,MacroGenics认为,ADAM9仍然是一个有前景的靶点,并开发了第2款ADAM9 ADC药物MGC028,其有效载荷为拓扑异构酶I抑制剂SYNtecan E,DAR约为4。
关于ADAM9
一个药物的开发失败并不代表这一靶点的失败。
ADAM9全称ADAM metallopeptidase domain 9,属于ADAM家族(金属蛋白酶蛋白),这个家族的成员能够参与多种生物过程。ADAM9在不同研究背景下也被称作MDC9、MCMP和Mltng。它可以切割并释放许多在肿瘤发生和血管生成中具有重要作用的分子,可介导细胞间、细胞基质间的相互作用,并通过与整合素的相互作用调节细胞的运动性。ADAM9在多个信号通路中扮演重要角色,比如Notch。同时,ADAM9还参与细胞外基质重塑。细胞外基质是细胞周围的支持结构,ADAM9通过降解这些基质成分,帮助细胞移动和侵袭。
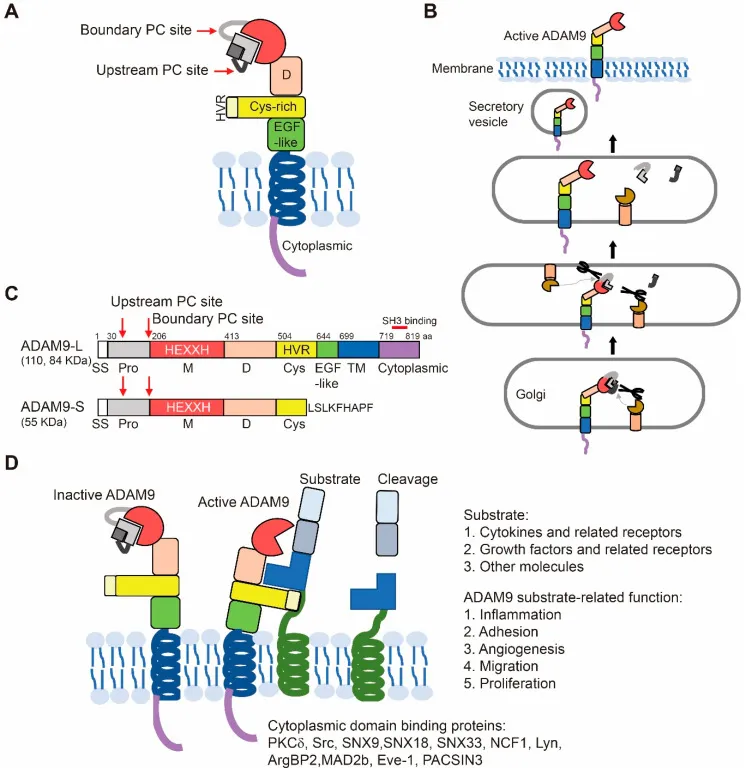
ADAM9的结构及激活过程
ADAM9在细胞中被检测到广泛表达,包括单核细胞、巨噬细胞、中性粒细胞、角质形成细胞和成纤维细胞;以及多种组织,包括肺、结肠、肾脏、血管平滑肌、神经系统、生殖系统和分泌器官等。
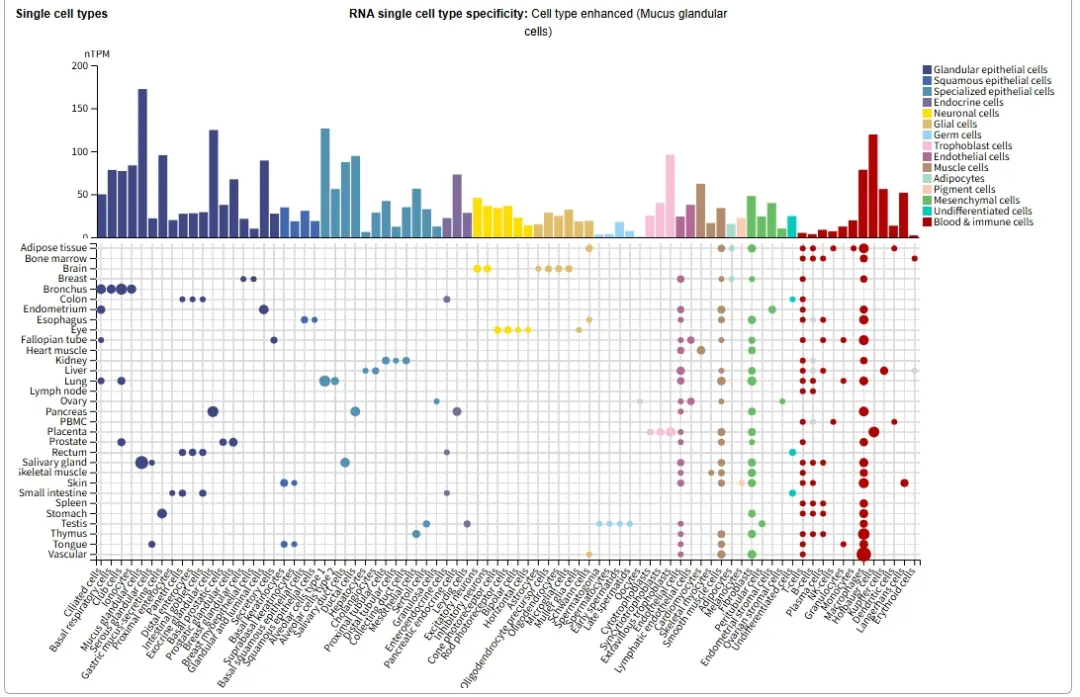
图片来源:HPA数据库
ADAM9的功能异常与多种疾病有关,尤其是在癌症和神经退行性疾病中。在癌症中,ADAM9的高表达通常与肿瘤的侵袭性和转移性增加相关,所以ADAM9在肿瘤细胞中广泛表达,例如脑癌,神经母细胞瘤,肾上腺皮质癌,肾癌,胰腺癌,乳腺癌,子宫颈癌等。
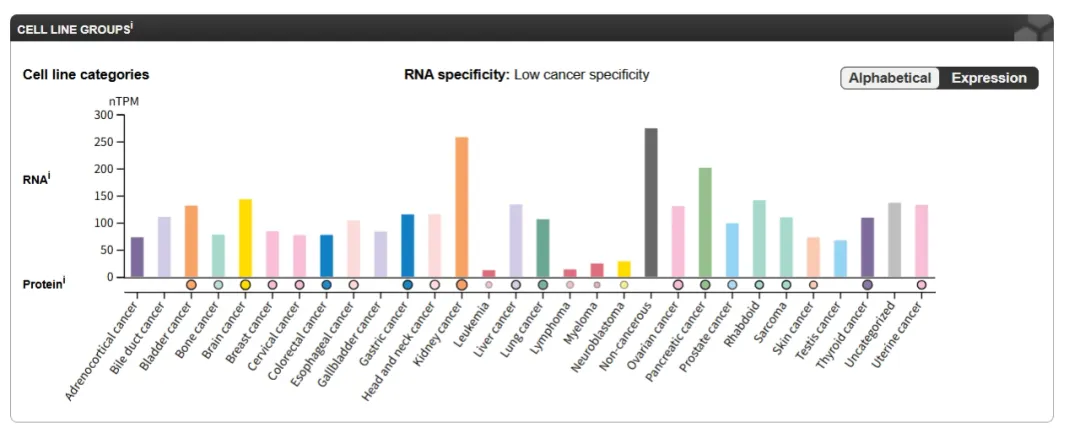
图片来源:HPA数据库
映恩生物的加速键
2025年4月,映恩生物在港交所上市, 8月26日,映恩生物公布其2025年上半年业绩,总营收12.29亿元,研发费用3.49亿元。营收主要来自交易合作,上半年映恩生物获得许可和合作交易首付款及里程金收入12.27亿元,后面陆续还将有里程金兑现。
未来半年,映恩生物和合作伙伴BioNTech计划向中美两地分别递交DB-1303上市申请,适应症领域分别为乳腺癌和子宫内膜癌。另外,还将有新载荷管线推进到临床阶段。
映恩生物是一家成立于2019年的临床阶段创新生物药公司,专注于为癌症和自身免疫性疾病患者研发新一代ADC治疗药物。基于对疾病生物学机制的深入研究和探索,映恩生物拥有13款自主研发的ADC候选药物管线。
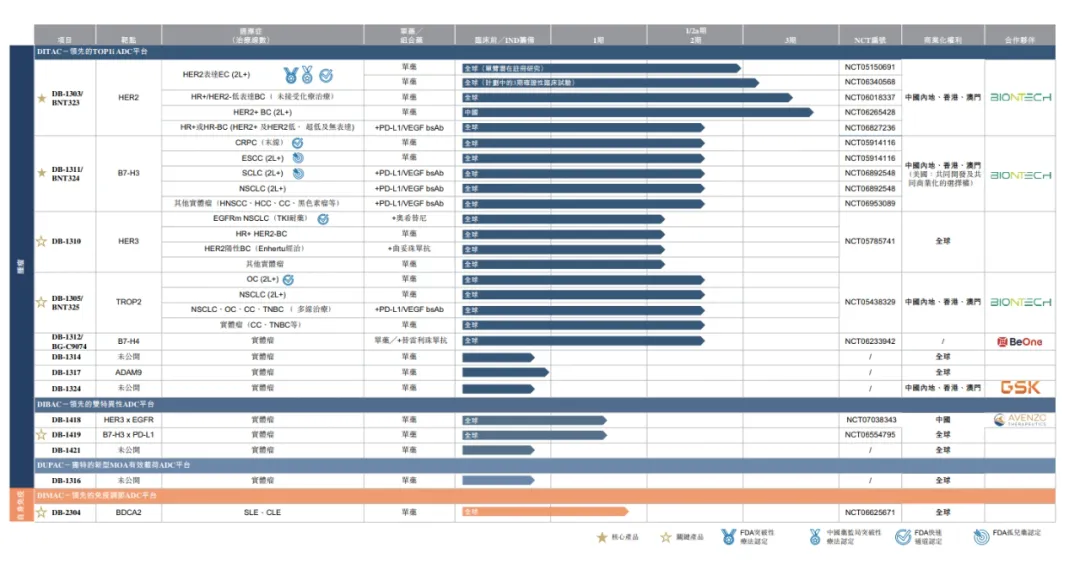
目前,映恩生物已成功构建了4个具有全球知识产权的新一代ADC技术平台:即免疫毒素抗体偶联平台(DITAC),专有的基于拓扑异构酶抑制剂的ADC平台;创新双特异性抗体偶联平台(DIBAC),双特异性ADC平台之一;免疫调节抗体偶联平台(DIMAC),
打开了ADC药物形式在自身免疫等重要空白市场的潜力;独特有效载荷抗体偶联平台(DUPAC),开发优于传统细胞毒性药物且具有新型作用机制的连接子。

未来,映恩生物还将在ADC药物开发上推进更多产品研发,在今年获得资本市场的资金支持后,映恩生物或将迎来跨越式的加速发展。

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 165
165

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 163
163

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 183
183