 研发追踪
研发追踪
 医药魔方Info
医药魔方Info  2025-09-05
2025-09-05
 765
765
9月4日,赛诺菲宣布Amlitelimab治疗特应性皮炎的III期COAST 1研究达到了所有主要终点和次要终点。

Amlitelimab是赛诺菲开发的一款靶向OX40L(OX40配体)的全人源非T细胞耗竭性单克隆抗体,可阻断关键免疫调节因子OX40L与其受体OX40结合,并保持促炎性T细胞和调节性T细胞之间的平衡,进而起到治疗特应性皮炎、哮喘、化脓性汗腺炎等一系列免疫性疾病和炎症性疾病的作用。该药物是目前唯一一款III期阶段OX40L抗体。
COAST 1研究是一项全球性、多中心、随机、双盲、安慰剂对照临床试验(n=601),评估了Amlitelimab对比安慰剂治疗患有中重度特应性皮炎的12岁及以上青少年和成人患者的有效性和安全性。在该研究中,试验组患者首先接受负荷剂量为500mg(体重低于40kg则减为250mg)的Amlitelimab治疗,随后接受每4周1次(Q4W)或每12周1次(Q12W)的Amlitelimab(250mg,体重低于40kg则减为125mg)治疗。
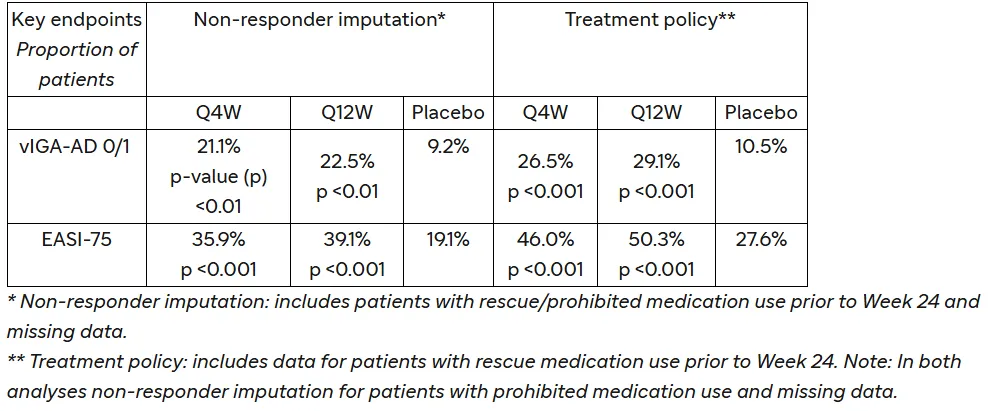
对于美国及美国参考国家,研究的主要终点是治疗第24周时达到经验证的特应性皮炎研究者全球评估量表(vIGA-AD)评分为0分或1分(vIGA-AD 0/1)且较基线至少降低2分的患者比例;对于欧盟、欧盟参考国家和日本,研究的主要终点是治疗第24周时达到vIGA-AD 0/1且较基线至少降低2分的患者比例以及达到湿疹面积和严重程度指数评分至少改善75%(EASI-75)的患者比例。
结果显示,从无应答者填补角度(包括在第24周之前使用过抢救/禁用药物且数据缺失的患者)评估,Amlitelimab(Q4W)组、Amlitelimab(Q12W)组和安慰剂组达到vIGA-AD 0/1的患者比例分别为21.1%、22.5%和9.2%,达到EASI-75的患者比例分别为35.9%、39.1%和19.1%。
若从治疗策略角度(包括在第24周之前使用过急救药物的患者)评估,Amlitelimab(Q4W)组、Amlitelimab(Q12W)组和安慰剂组达到vIGA-AD 0/1的患者比例分别为26.5%、29.1%和10.5%,达到EASI-75的患者比例分别为46.0%、50.3%和27.6%。
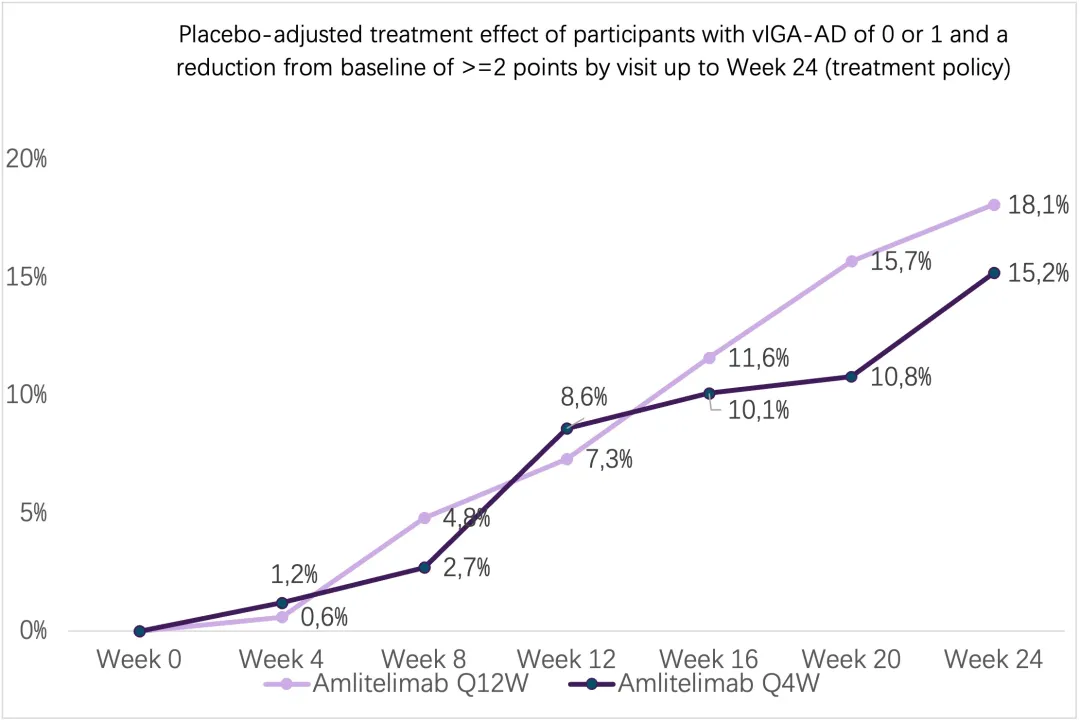
此外,在两个治疗组中,在治疗期间观察到疗效逐渐增加,没有平台期。
安全性方面,最常见(发生率占
≥5%)的治疗期间不良事件(TEAE)是特应性皮炎、鼻咽炎和上呼吸道感染,并且这些TEAE在安慰剂组中更为常见。Amlitelimab组的注射部位反应数值更高(Amlitelimab综合为2.2%,安慰剂为0.7%)。发热(Amlitelimab综合为1.1%,安慰剂组为0.7%)和寒战(Amlitelimab综合为0.4%,安慰剂组为0%)的发生率较低。总体而言,安慰剂组和Amlitelimab组的TEAE、严重不良事件和导致治疗中断的TEAE发生率相似。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 31
31

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 29
29

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 29
29