 研发追踪
研发追踪
 药明康德
药明康德  2025-09-08
2025-09-08
 1069
1069
礼来公司(Eli Lilly and Company)今日宣布,美国FDA已授予其KRAS G12C抑制剂olomorasib(LY3537982)突破性疗法认定,与抗PD-1疗法Keytruda(pembrolizumab)联用,一线治疗不可切除的晚期或转移性非小细胞肺癌(NSCLC)患者。这些患者携带KRAS G12C突变且PD-L1表达水平≥50%。

KRAS是所有肿瘤类型中最常见的致癌基因之一,而KRAS
G12C突变在约13%的NSCLC患者和1-3%的其他实体瘤患者中发生。Olomorasib是一款在研的口服高效且具高度选择性的第二代KRAS
G12C蛋白共价抑制剂,具备超过90%靶点占有率的潜力,潜在支持更安全、毒性更低的联合治疗。
这一突破性疗法认定主要基于LOXO-RAS-20001临床1/2期试验及SUNRAY-01临床3期试验剂量优化部分的积极数据。礼来在即将举行的世界肺癌大会(WCLC)研究中,将公布LOXO-RAS-20001和SUNRAY-01试验剂量优化队列一线患者接受olomorasib联合pembrolizumab的综合分析结果。
会议摘要显示,截至2025年1月15日,共有85例患者接受olomorasib联合pembrolizumab治疗,其中14例(17%)在入组前接受过一个周期的pembrolizumab治疗。患者群体中,63%为PD-L1≥50%,21%为PD-L1
1-49%,16%为PD-L1<1%(1例未知)。
在中位随访7.6个月时,最常见的治疗相关不良事件(TRAEs,发生率≥20%)包括腹泻(29%)和肝酶ALT/AST升高(26%/25%)。≥3级TRAEs主要为ALT/AST升高(18%/14%)和腹泻(7%),总体可通过剂量调整和/或糖皮质激素进行控制。安全性方面,29%的患者因不良事件降低剂量,9%的患者停用联合治疗。
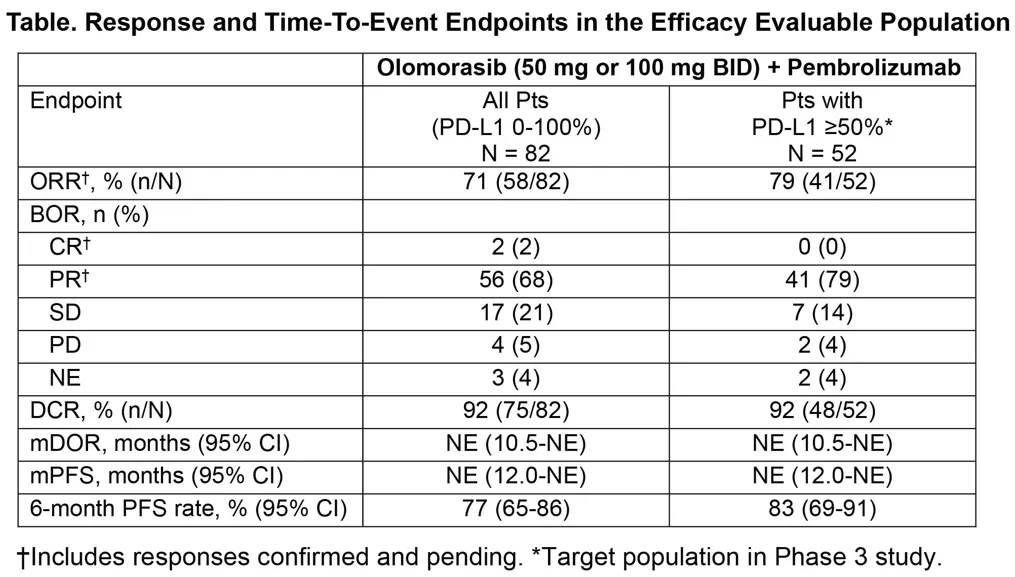
▲Olomorasib联合pembrolizumab治疗的试验结果摘要(图片来源:参考资料[2])
疗效方面,在所有可评估患者(n=82)中,客观缓解率(ORR)为71%,疾病控制率(DCR)为92%;在PD-L1≥50%且接受每日两次100 mg olomorasib治疗的患者中(n=26),ORR高达85%,DCR为92%。此外,该联合疗法展现出持久疗效,中位缓解持续时间(DOR)尚未达到,6个月无进展生存率达到77%。
这些最新数据进一步印证了olomorasib联合pembrolizumab在一线治疗KRAS G12C突变NSCLC患者中的潜力,并为正在进行的SUNRAY-01临床3期研究提供了有力支持。
英文:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 31
31

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 29
29

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 29
29