 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-09-09
2025-09-09
 1035
1035
2025年9月7日,正在西班牙巴塞罗那举行的2025年世界肺癌大会(WCLC)上,百利天恒和BMS共同开发的EGFR/HER3双抗ADC药物BL-B01D1,公布了和奥西替尼联用在EGFR突变的非小细胞肺癌一线治疗的最新数据。
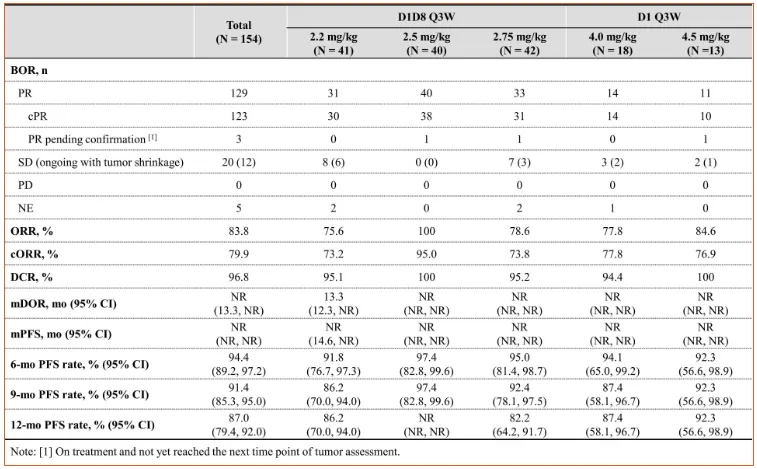
该项临床用2.2、2.5、2.75 mg/kg D1D8 Q3W和4.0、4.5 mg/kg D1 Q3W奥西替尼的BL-B01D1治疗一线EGFR突变的非小细胞肺癌患者。
截至 2025 年 3 月 10日,共有 154 名患者接受了BL-B01D1联合奥西替尼治疗。中位随访时间为11.3个月。所有接受至少一剂BL-B01D1的患者都包括在分析中。
2.5 mg/kg BL-B01D1加奥西替尼的 40患者中,ORR 为 100%,cORR 为 95.0%,1 PR 有待确认,中位 DOR 和 PFS 未达到,9 个月和 12 个月 PFS 率为 97.4% 未达到。
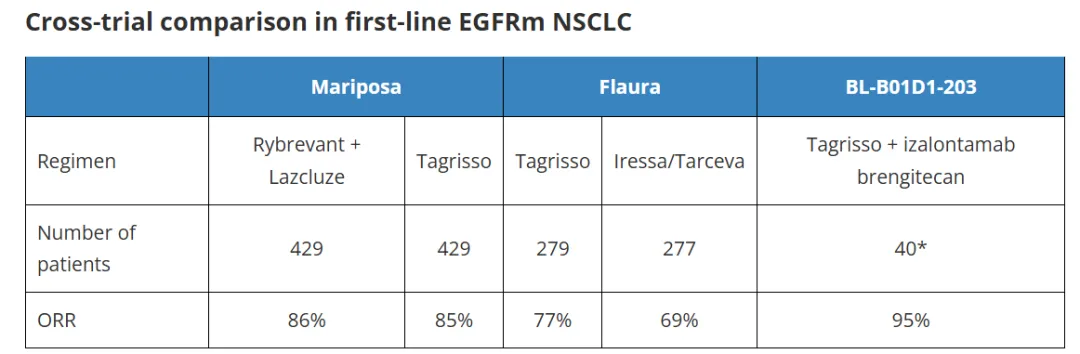
在交叉试验的基础上,该项联合治疗的数据与奥西替尼和 Rybrevant
产生的结果相比,这些数据看起来令人印象深刻,尽管值得记住的是,这是一项在中国进行的小型早期研究。而且,考虑到所有BL-B01D1剂量高达
4.5mg/kg,确认的 ORR 为 81%,与奥西替尼一致。
安全性方面,D1D8
Q3W中最常见的血液学TRAE(所有级别)是贫血(91.9%)、中性粒细胞减少(90.2%)、白细胞减少(90.2%)和血小板减少(72.4%);最常见的非血液学TRAE为恶心(67.5%)、口腔炎(66.7%)、食欲下降(49.6%)、呕吐(47.2%)、腹泻(46.3%)、ALT升高(45.5%)、AST升高(43.1%)、虚弱(42.3%)、低白蛋白血症(35.8%)、低钾血症(34.1%)、皮疹(30.9%)和脱发(30.9%)。
3 级及以上 TRAE 主要是血液学性质的,能够通过包括减少剂量在内的标准支持措施进行有效管理,TRAE 导致停药率为 14.9%。没有报告与治疗相关的间质性肺病 (ILD) 和死亡。没有观察到新的安全信号。
该项目临床仅报告了两例ILD(1例2级和1例3级),与其他ADC相比有明显改善,特别是与默沙东公司的抗HER3 ADC patritumab deruxtecan相比,后者面临重大安全问题。
其余不良事件与奥西替尼已知的安全性基本相似,停药率为12%。虽然这些是早期发现,但百利天恒今年早些时候开始了该适应症的 3 期试验,测试了奥西替尼联用与单独的奥西替尼,这应该可以更好地了解这些药物的叠加情况。
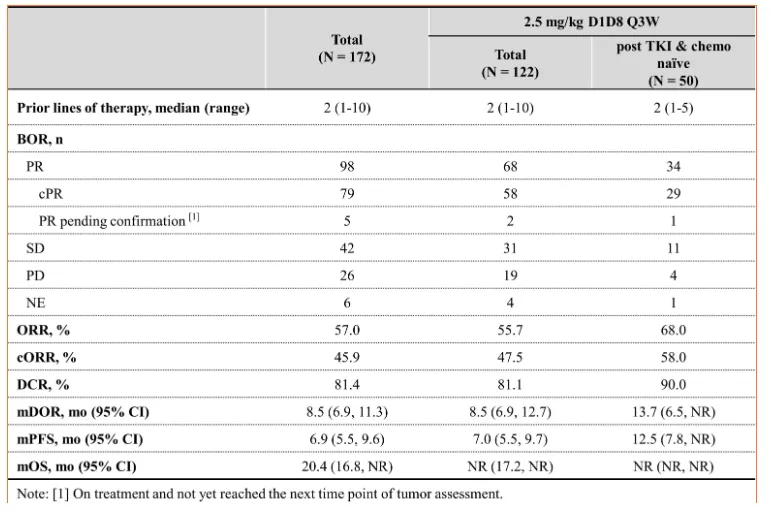
除了一线数据外,本次会议上,百利天恒还公布了参加 BL-B01D1-203 和 BL-B01D1-101 研究的 TKI 后未接受过化疗的亚组患者的结果。
这些 1/2 期试验包括 171 名剂量高达 6mg/kg 的患者,包括一线受试者和接受多线化疗的患者。百利天恒将重点放在 50 名 TKI 后、未接受过化疗的患者,给予 2.5mg/kg,中位随访时间为 15.4 个月,总体缓解率为 56%。所有 171 例患者的安全性似乎良好,仅报告了 1 例 1 级 ILD,治疗中断率为 1.2%。
展望未来,BMS计划在 10 月启动相关人群在全球的2/3 期试验,这项全球研究将重点关注 EGFR 酪氨酸激酶抑制剂后出现疾病进展的 EGFR 突变
NSCLC 患者。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 31
31

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 29
29

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 28
28