 产业资讯
产业资讯
 凯莱英药闻
凯莱英药闻  2025-09-12
2025-09-12
 1278
1278
肺癌作为全球范围内发病率和死亡率极高的恶性肿瘤,严重威胁着人类的生命健康。传统的肺癌治疗方法,如手术、化疗、放疗等在疗效和患者生存质量方面存在一定的局限性。而抗体药物偶联物(ADC)作为一种新兴的癌症治疗手段,在近年来研发管线快速增多,为肺癌治疗带来了新的希望。
根据Insight数据库,目前在肺癌领域共有293条ADC药物积极管线,其中62款药物为双抗ADC。适应症则主要集中在非小细胞肺癌(NSCLC),尤其是非鳞状NSCLC,也有部分药物针对小细胞肺癌(SCLC)。
在ADC药物中,单靶点集中分布在HER2、TROP2、B7H3、FRα和Nectin4。62款双抗ADC药物中,靶点则集中在 EGFRxcMet 和 EGFRxHER3。
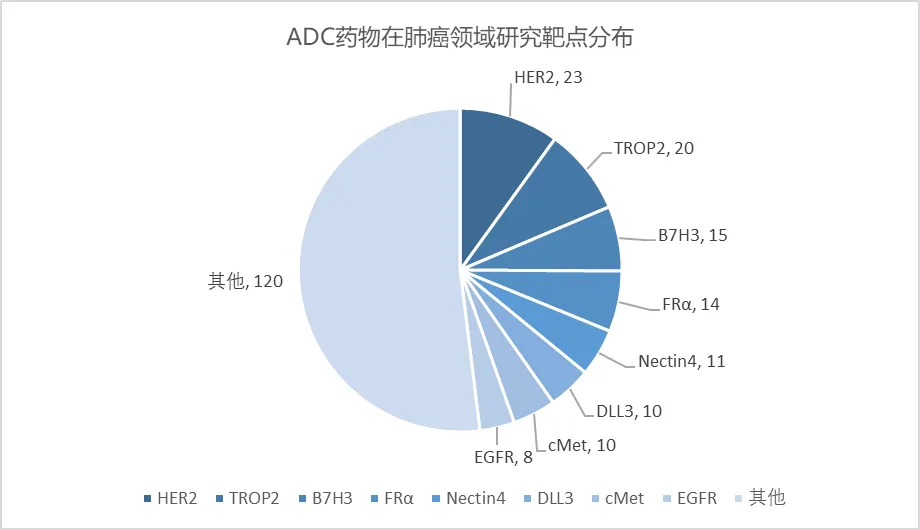
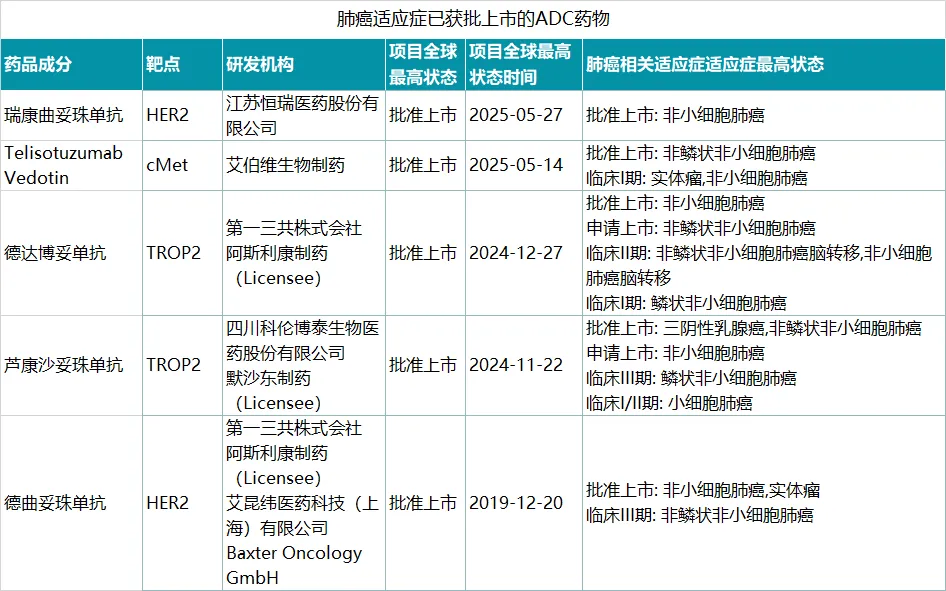
目前,已有5款ADC药物在肺癌适应症上获批,涵盖HER2、TROP2、c-Met等靶点。24款ADC药物处于III期临床阶段,主要集中在TROP2、HER3、B7-H3、DLL3等靶点。
2025 WCLC已落下帷幕,我们对WCLC会议上有良好数据的几款高热度ADC药物进行简单的盘点介绍。
百利天恒 iza-bren
伦康依隆妥单抗(Izalontamab Brengitecan,BL-B01D1,Iza-bren)是全球首创的EGFR/HER3双抗ADC 药物,其双抗部分是SI-B001,通过使用抗EGFR Fab 和抗HER3scFv 构建而成,随后与喜树碱衍生物Ed-04 小分子毒素结合,增强了针对性和安全性。BL-B01D1通过双目标交联促进协同内化,结合SI-B001和小分子毒素实现对EGFR依赖肿瘤的定向杀伤,同时也减轻了由HER3引起的药物耐药性。同时,BL-B01D1具有高达8的DAR值,在临床前研究中表现出的肿瘤杀伤效应明显优于EGFR单抗和HER3单抗。
本次 WCLC 公布两项关键研究数据,均入选官方新闻发布计划,覆盖 EGFR 突变NSCLC一线联合奥希替尼与后线单药治疗。
研究结果
研究一:一线联合奥希替尼,全球首个ORR 100%
iza-bren联合奥希替尼治疗局晚期/转移性EGFR突变NSCLC的II期研究(NCT05880706)。
截至2025年3月10日,该研究共纳入154例患者接受不同剂量iza-bren (EGFR×HER3双抗ADC) 联合奥希替尼治疗,其中 40 例患者接受iza-bren 2.5mg/kg D1D8 Q3W联合奥希替尼一线治疗。
所有患者均为最佳应答:ORR 100%,cORR 95%(2例PR待确认),DCR 100%,mDoR未达到。mPFS未达到,12个月PFS率92.1%;mOS未达到,12个月OS率94.8%。
脑转移患者(n=20):DCR 100%,初步显示血脑屏障穿透能力。
研究二:后线单药治疗,mPFS 12.5个月破纪录
iza-bren单药治疗局晚期或转移性EGFR突变NSCLC患者的I/II期研究
截至2024年12月5日,共纳入171例 EGFRmt NSCLC 患者;其中,121 例患者接受iza-bren 2.5mg/kg 的剂量治疗,在该治疗组中,有50例患者既往接受过EGFR-TKI但未接受过化疗。
总人群mPFS12.5个月、mDoR13.7个月,较现有后线标准治疗提升2倍以上。
ORR66%,cORR56%(1例PR患者待确认),DCR90%。
中位随访 20.5 个月,mOS 尚未达到,18 个月 OS 率为69.2%。
全球开发进展
基于优异数据,Iza-bren 2.5mg/kg D1D8 Q3W 联合奥希替尼的 III 期研究(NCT06838273)已在中国完成首例患者给药。
目前Iza-bren在中美开展近40项临床,与BMS合作推进NSCLC、三阴性乳腺癌等适应症II/III期研究;Iza-bren对比含铂双药治疗第三代EGFR-TKI进展后的EGFR突变NSCLC的中国III期多中心临床试验。2025年9月,Iza-bren还获CDE优先审评资格(既往经治鼻咽癌),5项适应症已纳入突破性疗法。
复宏汉霖 HLX43
HLX43是一款靶向PD-L1的广谱抗肿瘤ADC,兼具免疫检查点阻断与载荷细胞毒性的双重作用机制。临床前研究显示,HLX43在PD-1/PD-L1单抗耐药的非小细胞肺癌、宫颈癌、食管鳞癌等多个瘤种中显示出显著疗效,且耐受性良好。本次 WCLC 公布的是其I 期临床更新数据(含 Ia期剂量递增、Ib期剂量扩展阶段)。
研究结果
本次更新的NSCLC患者数据来自Ia期 +Ib期2.0 mg/kg剂量组及2.5 mg/kg剂量组。中位随访时间为9.0个月。截至2025年6月28日,共计56例NSCLC患者入组Ia期及Ib期2.0和2.5 mg/kg剂量组,经研究者评估,54例可评估疗效患者的ORR为37.0%,疾病控制率(DCR)为87.0%。
鳞状NSCLC(≥4L,n=28):ORR 28.6%、DCR 82.1%,较多西他赛标准治疗(ORR 12.8%)提升超 1 倍;其中多西他赛经治患者(n=10)ORR 达 30.0% ,DCR为80%。证明HLX43在后线治疗有重要潜力;
非鳞状NSCLC(≥3L,n=26):ORR 46.2%、DCR 96.2%;尤其EGFR 野生型非鳞癌(n=15)cORR 46.7%、DCR 93.3% ,2.5mg/kg 剂量组(n=5)cORR 更是高达 60.0%,DCR为80%,疗效优势显著。
晚期脑转移患者(n=11):cORR 36.4%、DCR 100%
PD-L1 阴性患者(TPS<1%,n=21):ORR 38.1%、DCR 85.7%,疗效不受PD-L1表达限制,有望覆盖更广泛的患者群体。
全球开发进展
目前HLX43已在全球入组300+患者,中、美、日、澳等多国推进国际多中心临床:
NSCLC适应症:中、美、日、澳已获批II期临床,中美完成首例给药;
罕见癌种:全球首个布局胸腺癌的 PD-L1 ADC,在美国已获临床许可;
其他实体瘤:同步探索宫颈癌、肝细胞癌、食管鳞癌等,“单药 + 联合” 方案并行。
恒瑞医药 SHR-4849
SHR-4849是恒瑞医药自主研发且具有知识产权的DLL3 ADC,其有效载荷是拓扑异构酶抑制剂(TOPOi)。DLL3 在多种实体瘤中表达,包括小细胞肺癌和神经内分泌肿瘤,但在正常组织中的表达有限。SHR-4849对DLL3中、高表达的不同肿瘤细胞系具有较强的增殖抑制活性。SHR-4849有明显的旁观者效应,可通过杀伤DLL3高表达细胞释放毒素来杀伤DLL3低表达细胞。
2024年12月,恒瑞医药与美国IDEAYA Biosciences 达成合作,将其除大中华区外的全球权益许可给后者,协议总金额达10.45 亿美元(含7500万美元首付款、2亿美元研发里程碑、7.7亿美元销售里程碑)。
本次WCLC公布的是其一项I期临床数据,该研究纳入既往治疗后疾病进展或复发的SCLC及其他DLL3阳性神经内分泌癌患者。入组患者每3周接受一次静脉给药。主要研究终点包括评估安全性、剂量限制性毒性(DLT)、最大耐受剂量(MTD)以及确定II期推荐剂量(RP2D)。
研究结果
该项研究包括100例接受SHR-4849治疗的患者的数据,剂量范围为0.8 mg/kg至4.2mg/kg,每3周给药一次。截至2025年6月20日,共纳入 87 名小细胞肺癌 (SCLC) 患者和13名其他神经内分泌癌 (NEC) 患者。
在剂量≥2.4mg的队列中,ORR达73.2%,DCR为93%。SHR-4849在二线治疗亚组中的疗效尤为突出,ORR和DCR分别高达77.1%和97.1%。
脑转移患者(n=18):ORR83.3%、确认ORR为66.7%,DCR100%。与总体人群的数据一致,凸显了SHR-4849在脑转移人群中具有令人鼓舞的活性。目前随访仍在进行中。
所有SCLC患者的mPFS为6.7个月。
全球开发进展
目前SHR-4849已开展两项临床,另一项临床试验为SHR-4849注射液联合其他抗肿瘤药物在恶性实体瘤患者中的多中心、开放Ⅱ期临床研究
齐鲁制药 QLC5508
QLC5508(MHB088C)是明慧医药利用其专有的SuperTopoi™ ADC平台开发的创新B7-H3靶向抗体偶联药物,以其强大的抗肿瘤活性和卓越的安全性而著称,显著扩大了治疗窗口。今年5月,明慧医药与齐鲁制药达成13.45亿元的合作,授予其大中华区开发、生产和商业化权利。
本次 WCLC 以口头报告形式公布其I期临床 I期临床试验广泛期小细胞肺癌(ES-SCLC)患者的更新数据研究结果。
研究结果
截至2025年6月13日,在1.6 mg/kg Q2W、2.0 mg/kg Q2W和 2.4 mg/kg Q3W三个剂量水平共入组106例SCLC患者。大多数患者(90.6%)为IV期SCLC、有20例(18.9%)患者存在基线脑转移病灶。既往曾经接受过一线、二线、三线和三线以上治疗的患者分别为55例(51.9%)、28例(26.4%)、15例(14.2%)和7例(6.6%)。超半数患者(58.5%)既往曾经接受过免疫治疗。有11例(10.4%)患者既往接受过伊立替康治疗。
疗效方面,1.6 mg/kg Q2W、2.0 mg/kg Q2W和 2.4 mg/kg Q3W三个剂量组确认的客观缓解率(ORR)分别为21.4%、42.2%、43.3%,疾病缓解率(DCR)分别为89.3%、84.4%、100%
中位无进展生存期(mPFS)分别为5.55个月、5.95个月和5.52个月。
中位总生存期(mOS)分别为11.50个月、11.73个月和11.50个月。
全球开发进展
目前 QLC5508 已启动肺癌、前列腺癌、食管癌等多个瘤种的II期、III期临床。未来,QLC5508有望联合齐鲁药业已上市创新药PD-1/CTLA-4双抗药物艾帕洛利托沃瑞利单抗,构建IO2.0+ADC的抗肿瘤治疗新格局。
默沙东/第一三共 I-DXd
Ifinatamab deruxtecan (I-DXd,DS-7300a)是一款潜在 first-in-class 靶向 B7-H3 的 ADC。该药采用第一三共独有的 DXd ADC 技术设计,由人源化抗 B7-H3 IgG1 单克隆抗体通过可裂解四肽连接子与拓扑异构酶 I 抑制剂有效载荷(一种依喜替康衍生物,DXd)连接组成。2023 年默沙东以超100亿美元合作获得其全球开发与商业化权益。目前,Ifinatamab deruxtecan是全球研发进展最快的B7-H3 ADC,本次WCLC公布的II期IDeate-Lung01研究数据,是该药物在SCLC领域的关键进展。
研究结果
该研究评估了I-DXd治疗既往接受过至多三线治疗的广泛期小细胞肺癌(ES-SCLC)患者的疗效和安全性,分为剂量优化和剂量扩展两部分。本次报告结果主要关注12mg/kg剂量组。
整体人群(n=137),cORR为48.2%,其中包括3例完全缓解(CR)和63例部分缓解(PR),DCR 87.6%;mDOR 5.3个月,mPFS 4.9个月,mOS 10.3个月。较现有ES-SCLC后线治疗提升明显。
二线人群(n=32)cORR 56.3%、DCR 96.9%,mDOR 7.2个月、mPFS 5.6个月、mOS 12.0个月,疗效优于三线及以上人群。
三线及以上人群(n=105)中,cORR为45.7%(3例CR、45例PR),DCR 84.8%。
全球开发进展
I-DXd目前在小细胞肺癌、食管癌、前列腺癌均已进入临床III期试验阶段。
IDeate-Lung02研究也正在进行中,该研究旨在对比I-DXd与多种化疗药物在一线铂类+依托泊苷经治的ES-SCLC患者中的疗效。
阿斯利康/第一三共 T-DXd
Trastuzumabderuxtecan(德曲妥珠单抗,T-DXd,商品名:Enhertu)是一种由第一三共与阿斯利康合作开发的 HER2 ADC,由人源化抗 HER2 抗体、酶促可裂解的肽接头和拓扑异构酶 I 抑制剂组成,目前已在美国和欧盟等多个地区获批于治疗已接受过全身治疗的不可切除或转移性人表皮生长因子受体 2 (HER2) 突变型非小细胞肺癌 (NSCLC) 患者。本次WCLC公布的是II期DESTINY-Lung05研究更新数据
研究结果
该研究旨在评估德曲妥珠单抗(5.4mg/kg)在中国经治HER2突变非鳞状NSCLC患者中的疗效和安全性。WCLC大会中,DESTINY-Lung05研究进一步更新了延长随访数据,首次公布了HER2 ADC在肺癌患者中的长期生存数据。
整体人群中,经ICR确认的ORR为59.7%,经研究者确认的ORR为56.9%,DCR为91.7%。
mOS达21个月,较传统HER2靶向药疗法提升110%。mDoR 为11.6个月,mPFS为9.9个月。
同时,本届WCLC大会中,第一三共还公布了III期临床DESTINY-Lung06的研究设计,旨在评估德曲妥珠单抗联合帕博利珠单抗对比帕博利珠单抗联合化疗一线治疗HER2过表达NSCLC患者的安全性和有效性。
艾伯维 SEZ6 ADC ABBV-706
ABBV-706是一款SEZ6 ADC,有效载荷为TOP1i,与毒素拓扑异构酶1抑制剂TOP1i通过连接子Valine-alanine结合,DAR为6。ABBV-706可靶向表达SEZ6的肿瘤细胞,迅速内化,并递送杀死肿瘤细胞的Top1i有效载荷。ABBV-706在各种SCLC细胞系中表现出显著的抗增殖活性,同时在SCLC PDX 模型中肿瘤出现持续消退。本次WCLC公布的是I期研究剂量优化队列中SCLC患者的安全性和有效性更新数据。
研究结果
研究共纳入了80名SCLC患者,其中1.8 mg/kg组(n=41),2.5 mg/kg组(n=39)。
整体人群中,既往治疗中位线数为2,治疗持续时间的中位数为5.8个月。ABBV-706在两个剂量下ORR表现相近,其中1.8 mg/kg剂量组的中位DoR和中位PFS更长。
目前报告数据看来,ABBV-706在复发难治性小细胞肺癌(R/R SCLC)患者中具有可控的安全性和有希望的疗效,更进一步的临床探索值得关注。
总结
ADC药物已逐步重塑肺癌的治疗格局。目前,研发焦点正从传统的HER2、TROP2靶点快速向B7-H3、DLL3、HER3等更多新靶点扩展,旨在覆盖更广泛的肺癌患者,特别是缺乏有效治疗方案的SCLC患者。
未来,随着更多临床数据的读出和药物的陆续上市,肺癌治疗将进入一个更加精准和个性化的“ADC时代”。同时,如何优化用药策略、克服耐药性以及探索合理的联合治疗方案,将是下一步临床研究的重点。

 产业资讯
产业资讯
 新药猎人笔记
新药猎人笔记  2025-11-24
2025-11-24
 70
70

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2025-11-24
2025-11-24
 66
66

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-11-24
2025-11-24
 65
65