 研发追踪
研发追踪
 药智数据
药智数据  2025-09-29
2025-09-29
 1421
1421
近日,施维雅宣布欧盟委员会(EC)已批准Vorasidenib用于治疗特定类型的2级IDH突变胶质瘤。这是欧盟首个专门针对这类脑肿瘤的靶向疗法,结束了患者长达二十余年的等待。
图片来源:PR Newswire
该批准适用于12岁及以上、体重至少40kg的成人和青少年患者,肿瘤类型主要为非增强性的2级星形细胞瘤或少突胶质细胞瘤,且携带IDH1 R132或IDH2 R172突变。符合条件的患者应仅接受过手术治疗,且不需要立即进行放疗或化疗。欧盟委员会(EC)的决定适用于27个欧盟成员国,以及挪威、列支敦士登和冰岛。
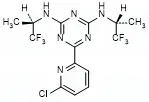
Vorasidenib是一种具脑渗透性与选择性的口服双重抑制剂,可同时抑制突变的IDH1和IDH2蛋白。其独特机制直接针对IDH突变型胶质瘤的发病根源,标志着这类肿瘤治疗模式的重大转变。突变后的IDH酶不再执行正常功能,反而产生大量致癌代谢物2-羟基戊二酸(2-HG)。2-HG积累会抑制细胞正常分化,导致组蛋白和DNA高度甲基化,从而驱动肿瘤发生发展。Vorasidenib通过抑制突变IDH酶的活性,降低2-HG水平,从根源上遏制肿瘤进展。
图片来源:药智数据企业版-全球药物分析系统(新版)
Vorasidenib的批准基于III期INDIGO临床试验的积极结果,该研究数据发表于《新英格兰医学杂志》。
试验结果显示:
Vorasidenib显著延长了患者的无进展生存期。接受vorasidenib治疗的患者中位无进展生存期达到27.7个月,而安慰剂组仅为11.1个月,疾病进展或死亡风险比降低61%。
Vorasidenib显著延迟了患者需要下一次干预的时间。安慰剂组中位至下次干预时间为17.8个月,而Vorasidenib组尚未达到。这意味着Vorasidenib治疗让患者推迟接受放疗或化疗的时间,避免了这些治疗可能带来的神经认知功能损伤。
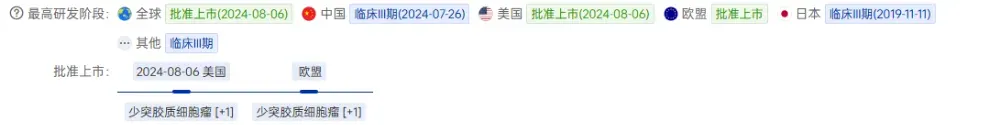
Vorasidenib已在多个国家和地区获得批准。
2024年8月获美国FDA批准上市,随后在加拿大、澳大利亚、以色列、瑞士等地获批。
2024年11月落地海南博鳌乐城先行区并实现“亚洲首用”。
2025年7月,Vorasidenib通过临床急需进口药械审批绿色通道,在北京天竺综合保税区先行先试。首批患者已在首都医科大学附属北京天坛医院、中国医学科学院北京协和医院接受治疗。
2025年度北京普惠健康保已将Vorasidenib纳入特药清单,参保患者可享受一站式特药报销服务。
图片来源:药智数据企业版-全球药物分析系统(新版)
随着Vorasidenib在全球更多地区的批准和应用,IDH突变型胶质瘤的治疗格局正在发生根本性改变。未来,Vorasidenib与免疫疗法等其他治疗手段的联合应用,有望为患者带来更多福音。
英文:
https://servier.mediaroom.com/2025-09-22-European-Commission-Approves-Serviers-VORANIGO-R-vorasidenib-as-the-First-Targeted-Therapy-for-Grade-2-IDH-Mutant-Glioma-in-the-EU#:~:text=BOSTON%2C%20Sept.%2022%2C%202025%20%2F%20PRNewswire%20%2F%20--,not%20in%20immediate%20need%20of%20radiotherapy%20or%20chemotherapy.

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 27
27

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 25
25

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 24
24