 研发追踪
研发追踪
 医麦创新药
医麦创新药  2025-09-29
2025-09-29
 1334
1334
当地时间 9 月 24 日,阿斯利康/第一三共宣布,其联合开发的重磅 ADC 药物 Enhertu(trastuzumab deruxtecan)联合帕妥珠单抗(pertuzumab)的 sBLA 已获美国 FDA 受理并授予优先审评资格,用于不可切除或转移性 HER2 阳性乳腺癌成年患者的一线治疗。
根据 PDUFA 时间表,FDA 预计 2026 年第一季度作出审评决定,若顺利获批,Enhertu 联合治疗方案有望成为 HER2 阳性转移性乳腺癌患者的一线标准治疗。
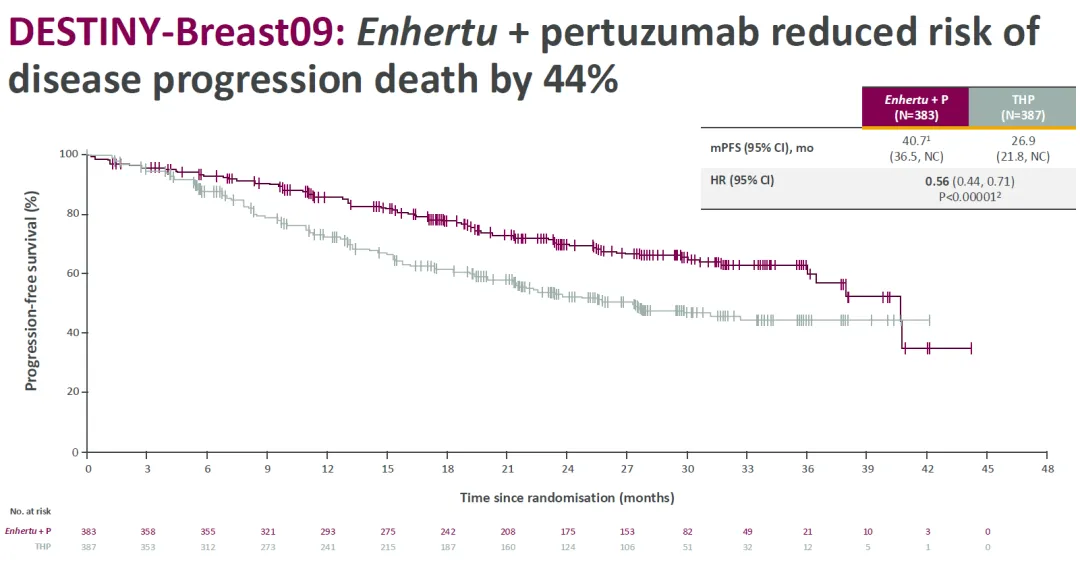
此次申报基于 III 期临床试验 DESTINY-Breast09 的顶线数据(已于今年 ASCO 会议公布),该试验以中位无进展生存期(mPFS)为主要终点。结果显示:
相比于 THP(紫杉醇+曲妥珠单抗+帕妥珠单抗)对照组,Enhertu+帕妥珠单抗治疗组的 mPFS 从 26.9 个月延长到 40.7 个月,将疾病进展或死亡风险降低 44%。
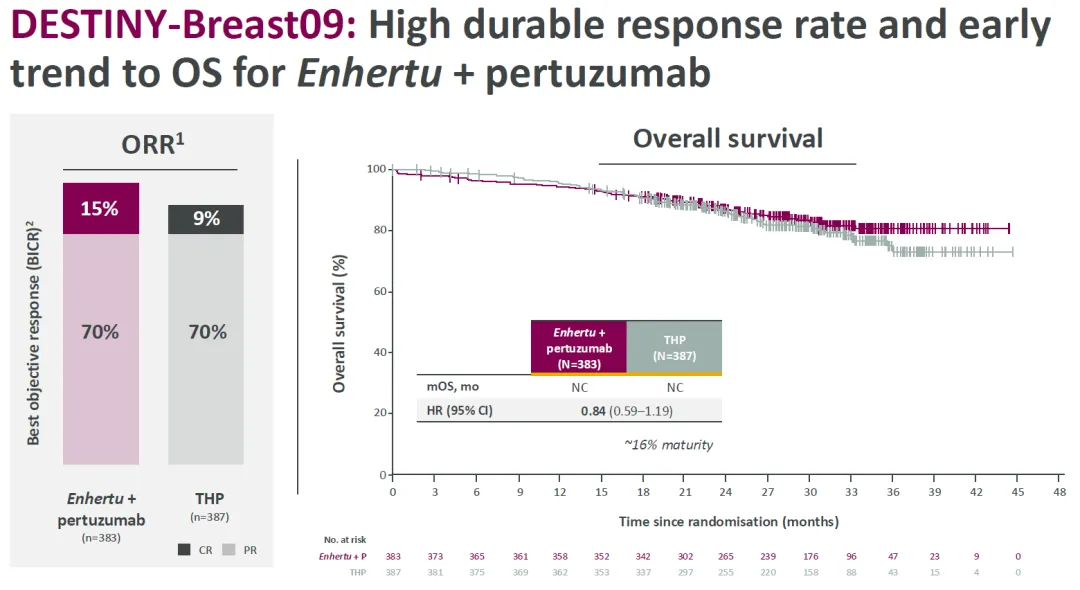
Enhertu+帕妥珠单抗治疗组和 THP 对照组的 ORR 分别为 85%、79%,mOS 均为达到,死亡风险降低 16%。
安全性方面,Enhertu 联合疗法的表现与各单药已知特征一致,未发现新的安全性问题。
Enhertu 是第一三共基于专有 DXd ADC 技术研发的 HER2 靶向药物,由曲妥珠单抗通过可裂解连接子偶联拓扑异构酶 I 抑制剂 payload(DXd),目前由阿斯利康与第一三共联合商业化(日本除外)。截至目前,Enhertu 已在全球超 85 个国家获批多项适应症,包括:
基于 III 期 DESTINY-Breast03 数据,获批上市用于 HER2 阳性乳腺癌二线治疗;
基于 III 期 DESTINY-Breast04 数据,获批上市用于 HER2 低表达(IHC1+或 IHC2+/ISH-)乳腺癌治疗;
基于 III 期 DESTINY-Breast06 数据,获批上市用于激素受体(HR)阳性、HER2 低表达/超低表达乳腺癌治疗;
同时在非小细胞肺癌、胃癌/胃食管交界处腺癌、HER2 阳性实体瘤等领域获多国批准上市。
阿斯利康肿瘤血液学研发执行副总裁 Susan Galbraith 指出,这是 HER2 阳性乳腺癌一线治疗十余年首重大突破 —— 约 1/3 患者无法接受二线治疗,一线 40.7 个月的 PFS 及近乎翻倍的完全缓解率,对改善预后至关重要。
商业层面,第一三共此前预测,依托 HER2 低表达晚期乳腺癌及 HER2 阳性早期乳腺癌等适应症增长,Enhertu 2026 年全球销售额有望翻番,超 75 亿美元,此次一线适应症推进将进一步释放其市场潜力。
英文:

 研发追踪
研发追踪
 医药魔方Info
医药魔方Info  2025-11-24
2025-11-24
 47
47

 研发追踪
研发追踪
 未来生物资讯
未来生物资讯  2025-11-24
2025-11-24
 46
46

 研发追踪
研发追踪
 药时空
药时空  2025-11-24
2025-11-24
 48
48