 研发追踪
研发追踪
 药明康德
药明康德  2025-09-29
2025-09-29
 1524
1524
礼来公司(Eli Lilly and Company)今日宣布,美国FDA已批准其口服选择性雌激素受体降解剂(SERD)Inluriyo(imlunestrant),用于治疗雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2–)、ESR1突变的晚期或转移性乳腺癌(MBC)成人患者,这些患者的疾病在至少一线内分泌治疗(ET)后出现进展。

根据GLOBOCAN的数据,乳腺癌是全球确诊人数第二高的癌症,仅次于肺癌。估计2022年新发病例达230万例,意味着约每4例新确诊的癌症中就有1例是乳腺癌。2022年乳腺癌导致约66.6万人死亡,成为全球癌症死亡的第四大原因。转移性/晚期乳腺癌是指癌症从乳腺组织扩散到身体其他部位。局部晚期乳腺癌则意味着癌症已扩散至原发部位之外,但尚未转移至其他身体部位。对于确诊时处于晚期的患者,生存率更低:局部病变的五年生存率为99%,区域性/局部晚期为86%,而转移性/晚期疾病则仅为30%。肿瘤大小等其他因素也会对五年生存率产生影响。
图片来源:123RF
此次FDA批准主要依据EMBER-3试验在携带ESR1突变的MBC患者群体(n=256)中的结果。入组患者在接受芳香化酶抑制剂(AI)辅助治疗期间疾病复发后接受Inluriyo或ET作为一线治疗(占21%);或在接受AI治疗疾病进展后接受Inluriyo或ET作为二线治疗(占79%)。
分析显示,Inluriyo较标准内分泌治疗将疾病进展或死亡风险降低了38%。在ESR1突变MBC患者中,Inluriyo显著改善了无进展生存期(PFS),与对照组相比,中位PFS分别为5.5个月和3.8个月(HR=0.62,95% CI:0.46-0.82;p=0.0008)。
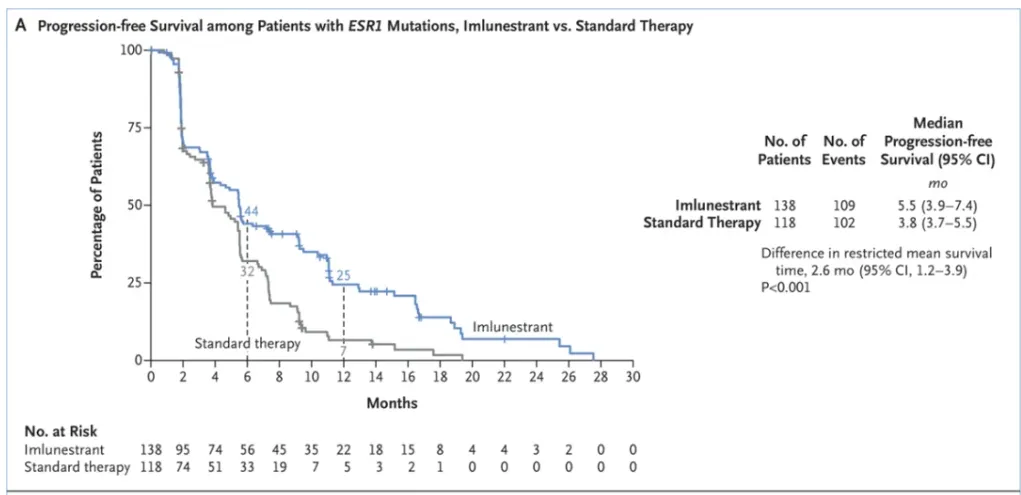
▲接受Inluriyo与标准内分泌治疗的ESR1突变患者的PFS结果(图片来源:参考资料[2])
在EMBER-3试验中,Inluriyo相关的大多数不良事件(AE)为低级别(1-2级)。包括实验室检测异常结果的最常见不良反应(≥10%)为血红蛋白降低、肌肉骨骼疼痛、钙降低、中性粒细胞减少、肝酶升高、疲劳、腹泻、甘油三酯升高、恶心、血小板减少、便秘、胆固醇升高和腹痛。在研究中,4.6%的患者因AE永久停药,2.4%的患者发生剂量降低,10%的患者发生剂量中断。
Inluriyo目前也正在进行3期EMBER-4试验的研究,评估其在辅助治疗中用于具有较高复发风险的ER+、HER2–早期乳腺癌(EBC)患者,全球计划入组约8000例患者。
英文:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 27
27

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 25
25

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 24
24