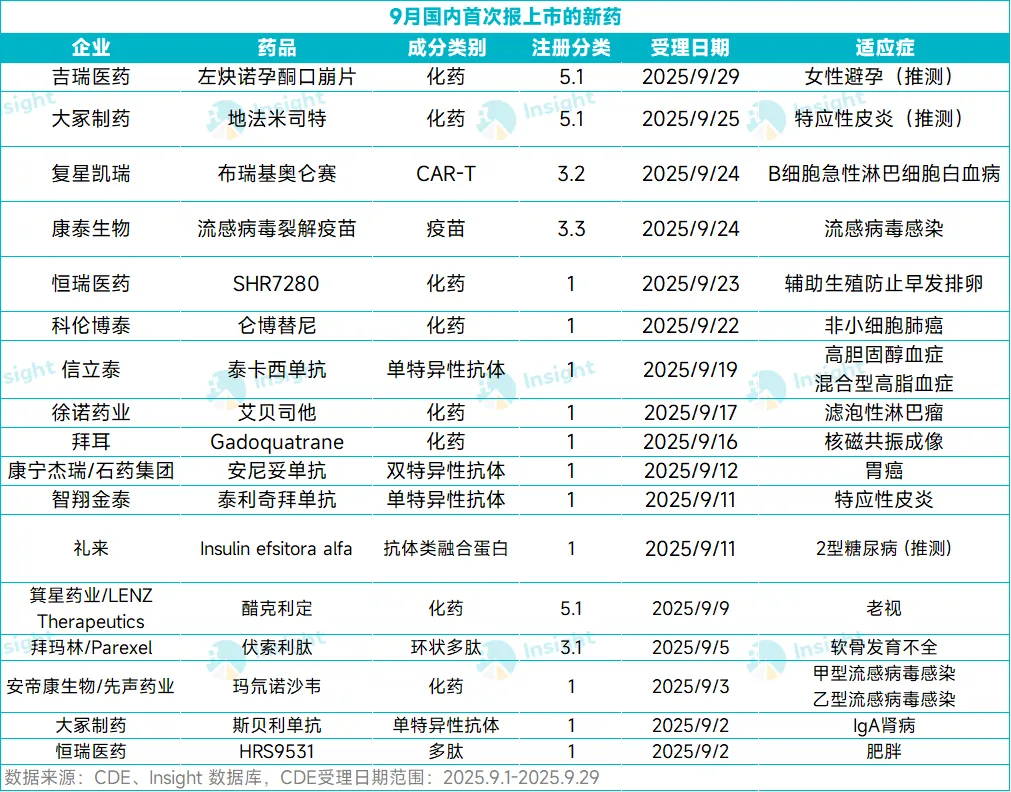
 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2025-10-01
2025-10-01
 2311
2311
今年九月,国内新药申报上市迎来了大爆发。
根据 Insight 数据库,截至 9 月 29 日,共计有 31 款新药在本月向 NMPA 递交了上市申请(含新适应症,不含原研地产化品种),数量为今年单月第 2 高。其中,国产药有 14 款,进口药有 17 款。药物类型上,化药有 14 款,生物药有 17 款。
从国内注册信息来看,31 款药中,有 17 个新药是首次申报上市,其中包括 11 款 1 类新药。本文将对其中几款首次报产的新药信息做介绍。
恒瑞医药:HRS9531
首个国产 GLP-1R/GIPR 双激动剂
9 月 2 日,恒瑞医药的 HRS9531 注射液上市申请获得受理,适应症为在控制饮食和增加运动的基础上用于成人的长期体重管理,患者的初始体重指数(BMI)需≥28 kg/m2(肥胖)或≥24 kg/m2(超重),并伴有至少一种体重相关合并症。
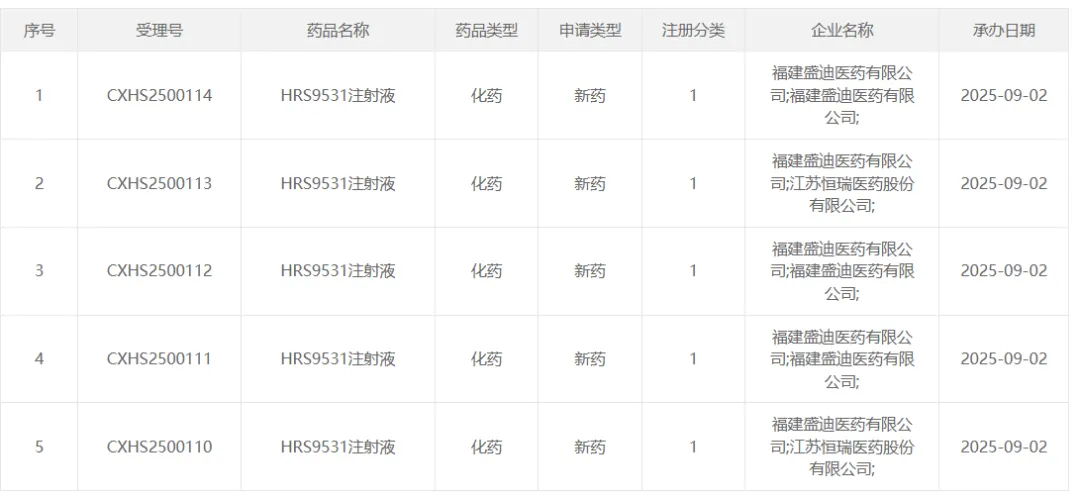
截图来源:CDE 官网
HRS9531 是一种同时靶向 GLP-1R 和 GIPR 的双激动剂。2025 年 7 月,HRS9531 注射液 Ⅲ 期临床试验(HRS9531-301)取得成功。研究结果表明,在主要疗效终点和所有关键次要疗效终点上,HRS9531 组显著优于安慰剂组,HRS9531 高剂量组平均体重降低达 19.2%,其中 44.4% 的受试者体重降低≥20%,而且安全性和耐受性良好。
Insight 数据库显示,在 GLP-1R/GIPR 双靶点新药赛道,全球现仅有礼来的替尔泊肽获批上市。恒瑞的 HRS9531 是首个报上市的国产 GLP-1R/GIPR 双激动剂。此外,还有多款同靶点新药在国内进入了 Ⅲ 期,来自翰森制药、博瑞生物、安进、众生药业、华东医药。
箕星药业/LENZ:盐酸醋克利定滴眼液
首个老花眼滴眼液
9 月 9 日,箕星药业和 LENZ Therapeutics 联合递交的盐酸醋克利定滴眼液上市申请获得受理,适应症为老视(俗称老花眼)。

截图来源:CDE 官网
LNZ100(盐酸醋克利定)是 LENZ 公司开发的一种以醋克利定为基础的滴眼液,主要用于改善老花眼患者的近视力。箕星药业拥有 LNZ100 在大中华区的开发和商业化独家权益。
今年 7 月 31 日, LNZ100 已在美国获批上市,成为了首个获批的老花眼眼药水。在国内,LNZ100(1.75% 醋克利定)用于治疗中国老视患者的 III 期临床研究 JX07001 已取得成功。
中国 Ⅲ 期研究数据显示,LNZ100 达到了主要终点和关键次要终点,最佳远矫正下的近视力 (BCDVA) 有三行或更佳的显著改善,并保持其最佳远视力(即视力下降不可超过 5 个字母)。而且大多数受试者在服用 LNZ100 后 30 分钟内就能起效,疗效可维持 10 个小时。
康宁杰瑞/石药集团:安尼妥单抗
首个国产 HER2 双抗
9 月 12 日,康宁杰瑞和石药集团津曼特生物申报的安尼妥单抗注射液上市申请获得受理,适应症为用于 HER2 阳性局部晚期、复发或转移性的胃/胃食管结合部腺癌二线治疗。该申请已被纳入优先审评。
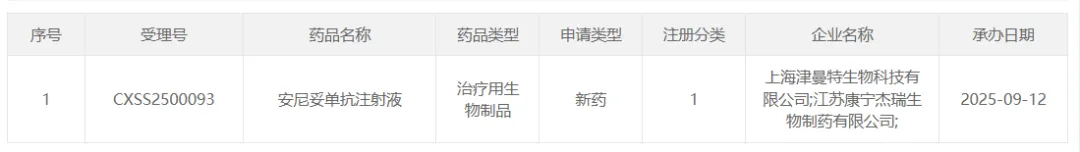
截图来源:CDE 官网
KN026 是康宁杰瑞自主研发的一种 HER2 双抗。2021 年 8 月,石药集团旗下津曼特生物与康宁杰瑞达成一项 10 亿元授权合作,获得了 KN026 在中国内地在乳腺癌、胃癌适应症上的排他性开发与独占性商业化许可权。
2024 年 ESMO 大会上公布的 II 期临床研究结果显示:KN026 联合化疗的客观缓解率为 40.0%,经独立评审委员会 (IRC) 评估的中位无进展生存期为 8.6 个月,中位总生存期为 13.2 个月。
本次上市申请主要是基于一项关键 II/III 期临床试验(KC-WISE)。III 期研究首次期中分析结果显示:与目前的标准治疗相比,KN026 联合化疗可显著提高患者的临床疗效,延长 PFS 和 OS,且无新发安全性风险,心脏毒性发生率低,免疫原性低。
根据 Insight 数据库,目前国内仅有百济神州从 Zymeworks 引进的泽尼达妥单抗一款 HER2 双抗获批上市,用于治疗胆道癌。康宁杰瑞和石药集团的 KN026 是首个报上市的国产 HER2 双抗,首发适应症为胃癌。
科伦博泰:仑博替尼
首个国产 RET 抑制剂
9 月 22 日,科伦博泰的富马酸仑博替尼胶囊上市申请获受理,适应症为用于治疗 RET 融合阳性局部晚期或转移性非小细胞肺癌 (NSCLC) 成人患者。此前,国内仅有两款进口 RET 抑制剂获批,仑博替尼是首个报上市的国产 RET 抑制剂。
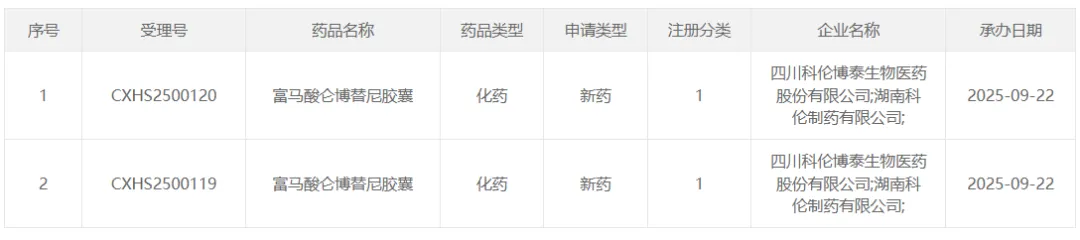
截图来源:CDE 官网
仑博替尼(A400)是一款新型下一代选择性 RET 抑制剂,拟开发用于治疗 NSCLC、甲状腺髓样瘤以及其它 RET 变异的高患病率实体瘤,具有克服第一代选择性 RET 抑制剂耐药的潜力。
本次上市申请是基于 KL400-I/II-01 研究中的两个关键 Ⅱ 期队列治疗一线和二线及以上 RET 融合阳性 NSCLC 的积极结果。数据显示,两个关键临床研究队列已达到主要有效性终点,RET+ NSCLC 一线治疗的 ORR 为 80.8%,二线以上晚期 RET+ NSCLC 的 ORR 为 69.7%。同时,仑博替尼还展示出了可管理的耐受性和安全性。
2021 年 3 月,科伦博泰已将仑博替尼在大中华区及部分亚洲国家之外的开发、制造及商业化独家权益授权给了英国 Ellipses Pharma 公司(研发代号为 EP0031)。在海外,仑博替尼已获得美国 FDA 授予快速通道资格,用于治疗 RET 融合阳性 NSCLC,并正在美国、英国、欧盟和阿联酋开展临床试验。
信立泰:泰卡西单抗
第 5 款国产 PCSK9 单抗
9 月 19 日,信立泰的泰卡西单抗注射液上市申请获得受理,适应症为用于高胆固醇血症和混合型血脂异常。这是第 5 款报产的国产 PCSK9 单抗。
截图来源:CDE 官网
目前国内已有 7 款 PCSK9 靶向疗法获批,其中只有诺华的英克司兰钠是 siRNA,其它 6 款都是 PCSK9 单抗,分别来自安进、赛诺菲、信达、康方、君实、恒瑞。值得一提的是,由于全球原料供应短缺以及优化心血管市场的策略和管线等原因,赛诺菲将停止波立达 (阿利西尤单抗) 在中国市场的推广,并将逐步退出中国市场。
信立泰公告指出,国内已上市的 PCSK9 单抗,若每 4 周一次皮下注射,需要同时注射 2-3 针或无菌配药。而泰卡西单抗虽然也是每 4 周一次皮下注射,但一次只需一针,有望大幅提升患者用药便利性和治疗依从性。
智翔金泰:泰利奇拜单抗
第 3 款国产 IL-4Rα 单抗
9 月 11 日,智翔金泰泰利奇拜单抗(GR1802)注射液上市申请获得受理,适应症为中、重度特应性皮炎。这是第 3 款报产的国产 IL-4Rα 单抗。
截图来源:CDE 官网
GR1802 用于中、重度特应性皮炎适应症的 III 期临床试验已达到了主要疗效终点。除了特应性皮炎,GR1802 还正在开展针对慢性鼻窦炎伴鼻息肉、慢性自发性荨麻疹、成人季节性过敏性鼻炎、青少年季节性过敏性鼻炎适应症的 Ⅲ 期临床。
根据 Insight 数据库,目前全球共有两款 IL-4Rα 单抗获批上市,分别为赛诺菲/再生元的度普利尤单抗、康诺亚/津曼特生物的司普奇拜单抗。其中,度普利尤单抗是全球首个获批的 IL-4Rα 单抗,2024 年全球销售额为 140.89 亿美元,2025 上半年销售额为 73.12 亿欧元(约 80 亿美元)。
在国内,除了已获批的度普利尤单抗和司普奇拜单抗,康乃德/先声药业的乐德奇拜单抗、智翔金泰的泰利奇拜单抗已申报上市。此外,还有 7 款在研产品正在开展 Ⅲ 期临床,来自正大天晴/博奥信、恒瑞、康方、荃信生物、三生国健、麦济生物、齐鲁,竞争非常激烈。
第二款 CAR-T 报上市
9 月 24 日,复星医药旗下复星凯瑞(曾用名复星凯特)的布瑞基奥仑赛注射液上市申请获受理,适应症为复发或难治性前体 B 细胞急性淋巴细胞白血病(ALL)成人患者。

来源:CDE 官网
布瑞基奥仑赛(Brexucabtagene autoleucel、KTE-X19)是吉利德科学旗下 Kite Pharma 开发的一种靶向 CD19 的 CAR-T 细胞疗法。此前,该药已在美国、欧盟、加拿大等国家和地区获批上市,用于治疗套细胞淋巴瘤、B 细胞急性淋巴细胞白血病(B-ALL)。
复星凯瑞拥有布瑞基奥仑赛在中国内地、香港、澳门地区的权益,目前正在中国内地开展布瑞基奥仑赛治疗套细胞淋巴瘤、B-ALL 的单臂 Ⅱ 期临床。今年 6 月,复星凯瑞公布了 KTE-X19 在中国 R/R B-ALL 患者中的桥接注册临床研究的最新结果,该试验主要终点为中心评估的 CR/CR 伴不完全血液学恢复(CRi)率。
截至 2024 年 10 月 28 日,共纳入 28 例患者接受 KTE-X19 回输(1×10⁶ CAR-T 细胞/kg)。疗效性数据显示:中位随访 8.1 个月时,CR/CRi 率为 78.6%;中位 DOR、中位 RFS 和中位 OS 均未达到,所有应答者的 MRD 检测结果均为阴性(100%)。安全性数据显示,在中国人群中未观察到新的安全性信号。
此前,复星凯瑞从 Kite Pharma 引进的 CD 19 CAR-T 阿基仑赛已在国内获批,用于治疗弥漫性大 B 细胞淋巴瘤、原发纵隔大 B 细胞淋巴瘤。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 27
27

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 25
25

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 24
24