 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-10-01
2025-10-01
 1632
1632
2025年,中国创新药在全球市场的拓展进程中成绩斐然。仅上半年,中国药企对外授权合作的总金额便高达635.5亿美元,这一数字不仅超越了2024年全年561.2亿美元的规模,更在全球license-out交易总额中占据了约40%的份额。
出海药企中既有恒瑞医药、百济神州、石药集团等行业领军企业,也有众多充满活力的新兴生物医药公司。在出海模式上,呈现出多元化的显著特征,包括License-out、海外并购与合作、自主申报、NewCo模式等。从出海药物的类型来看,涵盖了抗体偶联药物(ADC)、双特异性抗体、GLP-1药物、小分子药物以及细胞基因治疗等多个前沿领域,充分展示了中国创新药在研发和技术创新方面的强大实力与广阔前景。
小编将2025年1-9月国产创新药出海交易金额TOP30的事件整理如下表所示:
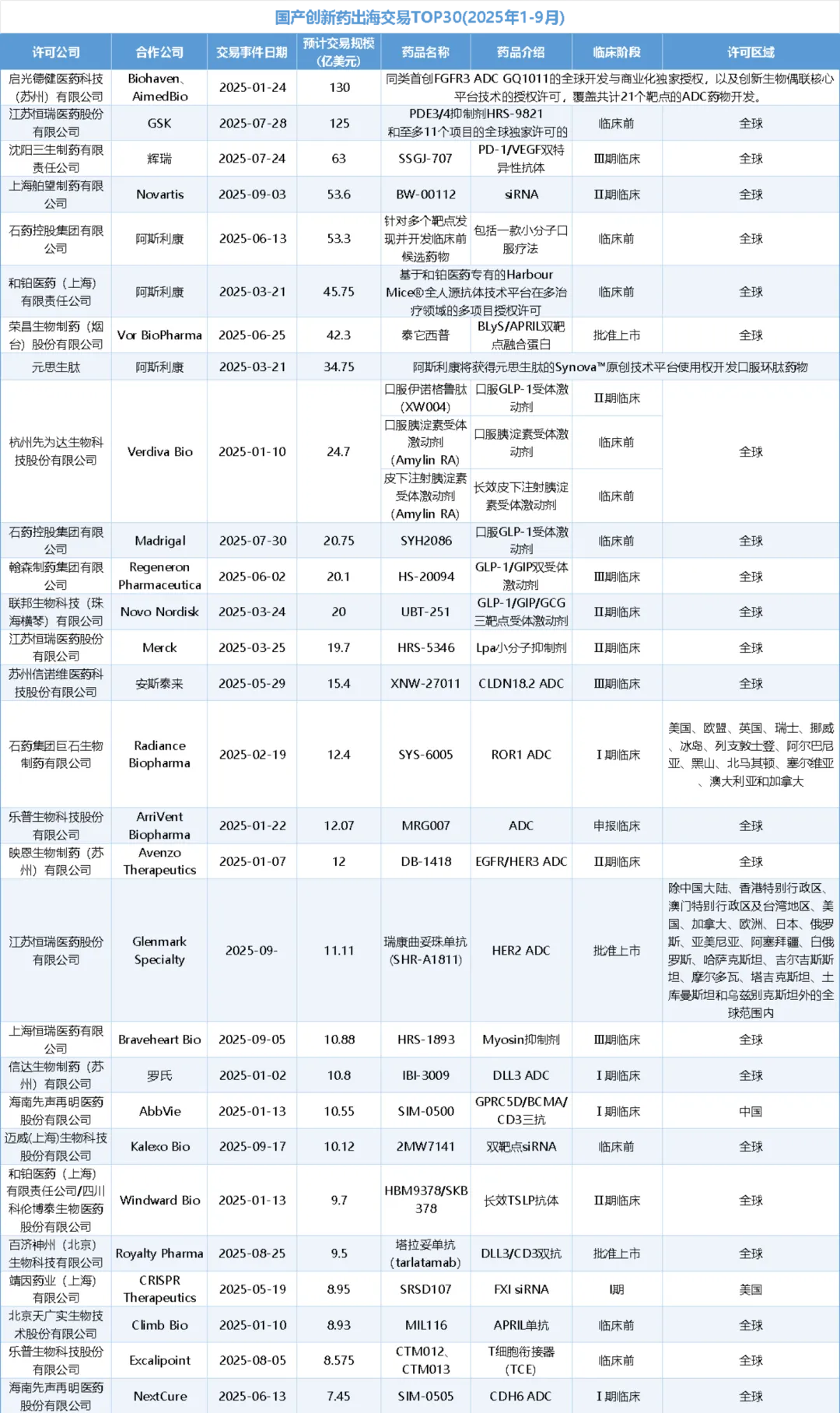
TOP1
130亿美元:
启德医药&Biohaven、AimedBio
2025年1月24日,启德医药在苏州研发总部举行了重大商务合作签约仪式,协议内容为与Biohaven、AimedBio合作开发FGFR3 ADC药物GQ1017(GQ1011)以及授权其创新生物偶联核心技术平台,“赋能”合作伙伴共计21个靶点的ADC药物创新,交易总金额超过130亿美元。

具体合作情况为:
启德医药与AimedBio达成一项偶联平台技术授权的多靶点创新ADC药物开发合作协议。双方前期在FGFR3靶点同类首创ADC药物开发中创建了国际合作协同创新的新模式。本次合作是AimedBio寻求在更多创新靶点和疾病领域采用启德医药核心技术赋能,进一步扩大合作范围。
启德医药与Biohaven签署了两项战略合作协议。根据第一项协议,Biohaven将获得启德医药与AimedBio联合开发的FGFR3靶点同类首创ADC药物的全球开发和商业化权益。第二项协议通过启德医药核心偶联技术授权许可,未来5年赋能Biohaven及其合作伙伴Merus针对18个特定靶点开发创新ADC药物。
TOP2
125亿美元:恒瑞医药&GSK
7月28日,江苏恒瑞医药股份有限公司宣布与 GSK达成协议,将HRS-9821项目的全球独家权利(不包括中国大陆、香港特别行政区、澳门特别行政区及台湾地区)和至多11个项目的全球独家许可的独家选择权(不包括中国大陆、香港特别行政区、澳门特别行政区及台湾地区)有偿许可给GSK。

GSK为此将向恒瑞支付5亿美元的首付款。如果所有项目均获得行使选择权且所有里程碑均已实现,恒瑞将有资格获得未来基于成功开发、注册和销售里程碑付款的潜在总金额约120亿美元。同时,恒瑞将有权向GSK收取相应的分梯度的销售提成(不包括中国大陆、香港特别行政区、澳门特别行政区和台湾地区)。
HRS-9821 是一款潜在的同类最佳PDE3/4抑制剂,目前正处于临床开发阶段, 可用于治疗慢性阻塞性肺病(COPD),作为辅助维持治疗,无需考虑既往治疗方案。 除HRS-9821外,协议还包括合作开发最多11个项目,覆盖肿瘤、呼吸、自免和炎症等多个治疗领域,均处于临床前研究阶段,每个项目均拥有各自的财务结构。恒瑞将主导这些项目的研发,最晚至完成包括海外受试者数据的Ⅰ 期临床试验。GSK将拥有在最晚至Ⅰ期临床完成时,行使全球(不包括中国大陆、 香港特别行政区、澳门特别行政区和台湾地区)进一步开发和商业化每个项目的 独家选择权,以及某些项目替换权。
TOP3
63亿美元:三生制药&辉瑞
5月20日,三生制药发布公告称,公司与辉瑞就PD-1/VEGF双特异性抗体SSGJ-707订立许可协议,辉瑞将获得该产品在全球(不包括中国内地)的独家开发及商业化权利。三生制药将获得12.5亿美元首付款及最多48亿美元的潜在付款,包括开发、监管批准及销售里程碑付款,并收取双位数百分比的特许权使用费。

7月24日,双方同意,三生制药在获得12.5亿美元首付款的基础上,额外获得1.5亿美元款项,以进一步授予辉瑞在中国内地独家开发和商业化SSGJ-707的权
利。同时,辉瑞将认购三生制药价值1亿美元的普通股股份。
SSGJ-707 是三生制药旗下三生国健基于其专有 CLF2 平台自主研发的一款创新的 PD-1/VEGF 双特异性抗体药物。其针对PD-L1阳性、局部晚期或转移性非小细胞肺癌(NSCLC)的一线治疗的 Ⅲ 期临床研究已获国家药监局药品审评中心(CDE)批准启动,与帕博利珠单抗单药或联合化疗进行头对头对比。同时,该产品也获得了美国 FDA 的新药临床试验(IND)批准。
TOP4
53.6亿美元:舶望制药&诺华
9月3日,舶望制药宣布,与诺华达成一项新战略合作协议,双方共同开发多项心血管产品。此前,双方曾达成合作,此次新达成的协议是现有合作基础上的进一步拓展。

新合作协议包括:
舶望制药授予诺华两款处于早研阶段分子的中国以外权益的选择权,用于治疗重度高甘油三酯血症 (sHTG) 和混合型血脂异常,以及就BW-00112 (ANGPTL3) 产品的优先谈判权。该产品目前在美国和中国处于 II 期临床试验阶段,后续将由舶望制药主导开展联合用药的临床试验。
针对另一款处于临床前研究阶段的 siRNA 候选药物,舶望制药授予诺华独家中国地区以外许可,并包含在美国和中国分享损益 (P&L) 的互惠选择权,该产品预计 2026 年将启动I 期临床试验。
舶望制药将获得1.6亿美元的预付款,并可能获得潜在的里程碑和期权付款以及商业销售的分级特许权使用费,总潜在里程碑价值高达52亿美元。 此外,诺华公司已初步意向参与舶望制药的下轮股权融资,其具体参与(包括投资金额与时间)仍需履行例行尽职调查、并由双方协商并签署正式协议来确定。
TOP5
53.3亿美元:石药集团&阿斯利康
6月13日,阿斯利康与石药集团达成战略研究合作,双方将针对多个靶点发现并开发临床前候选药物,这些药物有望治疗慢性疾病,包括一款用于治疗免疫疾病的临床前小分子口服疗法。

根据协议,石药集团将获得1.1亿美元的预付款,并有资格获得最高16.2亿美元的潜在开发里程碑付款以及最高36亿美元的销售里程碑付款,此外还有基于产品年度净销售额的潜在个位数特许权使用费。阿斯利康将有权选择对全球范围内通过本协议确定的候选药物进行独家许可开发和商业化。
该研究将由石药集团在石家庄市开展,并利用其人工智能驱动的双重引擎高效药物发现平台。该平台运用人工智能技术分析目标蛋白与现有化合物分子的结合模式,开展针对性优化,旨在筛选出高效且具有良好开发性的小分子。
TOP6
45.75亿美元:和铂医药&阿斯利康
2025年3月21日,和铂医药宣布与阿斯利康达成全球战略合作,双方将共同研发针对免疫性疾病、肿瘤及其他多种疾病的新一代多特异性抗体疗法。

根据协议,阿斯利康获得两项临床前免疫学项目的授权许可选择权,并将提名更多靶点由和铂医药开发新一代多特异性抗体疗法,阿斯利康可行使选择权以推进这些项目进入临床开发阶段,未来还将拓展至更多项目的合作。
和铂医药将获得总计1.75亿美元的首付款、近期里程碑付款和额外新增项目的选择权行使费,以及最高达44亿美元的研发及商业里程碑付款,外加一定比例的销售分成。双方可选择在未来五年内将更多项目纳入合作范围,并可在双方同意的情况下将协议期限再延长五年。协议总金额高达45.75亿美元。
TOP7
42.3亿美元:荣昌生物&Vor Bio
6月25日,荣昌生物宣布,将公司具有自主知识产权的泰它西普有偿许可给美国纳斯达克上市公司Vor Biopharma,Vor Bio将获得泰它西普在除大中华区以外的全球范围内开发、生产和商业化的独家权利。

根据协议,荣昌生物将取得Vor
Bio价值1.25亿美元现金及认股权证(包括4500万美元的首付款和价值8000万美元的认股权证,认股权证可以每股0.0001美元认购Vor Bio
3.2亿股的普通股,约占Vor
Bio经扩大总发行股本的23%)、最高可达41.05亿美元的里程碑付款,总金额42.3亿美元,此外荣昌生物还将收到高个位数至双位数销售提成款。
泰它西普是荣昌生物自主研发的全球首款、同类首创(first-in-class)的注射用重组B淋巴细胞刺激因子(BLyS)/增殖诱导配体(APRIL)双靶点的新型融合蛋白产品,可同时抑制BLyS和APRIL两个细胞因子与B细胞表面受体的结合,阻止B细胞的异常分化和成熟,从而治疗自身免疫性疾病。目前,泰它西普治疗重症肌无力、系统性红斑狼疮、类风湿关节炎三个适应症已获批国内上市,商业化保持快速增长态势,2024年销售量突破150万支。泰它西普重症肌无力适应症全球多中心Ⅲ期临床试验进展顺利,该适应症已获得美国食品药品监督管理局(FDA)快速通道资格认定和孤儿药资格认定,以及欧盟孤儿药资格认定。
TOP8
34.75亿美元:元思生肽&阿斯利康
3月21日,创新口服大环肽药物研发企业元思生肽 (Syneron Bio)宣布与阿斯利康达成战略合作,共同开发针对慢性疾病的全球首创大环肽类药物。根据协议,阿斯利康将获得元思生肽的Synova™原创技术平台使用权。该智能化高通量大环肽药物研发平台将助力推进针对罕见病、自身免疫及代谢疾病等慢性疾病的创新药研发。

根据协议条款,阿斯利康将支付7500万美元首付款及近期里程碑付款、总计可达34亿美元的研发及商业化里程碑付款,并根据全球销售额支付分级特许权使用费。此外,阿斯利康还将对元思生肽进行股权投资。元思生肽计划通过此次合作扩建其北京研发中心。
据悉元思生肽之前叫呈元科技,投资者包括高瓴创投、礼来亚洲基金、五源资本、创新工场、联想创投和格力产投等。
TOP9
24.7亿美元:先为达生物&Verdiva Bio
1月10日,先为达生物宣布与Verdiva Bio达成了在除大中华区及韩国以外的全球开发和商业化许可与合作协议。

此次合作的产品组合包括:
口服伊诺格鲁肽(Ecnoglutide Oral,XW004):一个处于2期临床试验准备阶段的每周一次口服GLP-1受体激动剂。
口服胰淀素受体激动剂(Amylin RA):一个处于临床前阶段的的每周一次口服胰淀素受体激动剂,可用作单药治疗或与GLP-1受体激动剂联合使用。
皮下注射胰淀素受体激动剂(Amylin RA):一个处于临床前阶段的长效皮下注射胰淀素受体激动剂,可用作单药治疗或与GLP-1受体激动剂联合使用。
根据合作协议,先为达生物将授予Verdiva在大中华区和韩国以外的全球范围内开发、生产和商业化合作上述产品组合的独家权利。先为达生物将保留在协议地区以外区域的开发、生产和商业化权利。先为达生物将获得近7000万美元的签约首付等款项,并有权获得上述产品最高达24亿美元的潜在开发、注册和商业化里程碑付款,以及产品商业化后的分层销售额提成。两家公司还将在其他临床前阶段项目上进行合作,先为达生物有权获得相应的里程碑收入和销售额提成。
TOP10
20.75亿美元:石药集团&Madrigal
2025年7月30日,Madrigal Pharmaceuticals宣布已与石药集团就临床前口服小分子胰高血糖素样肽-1(GLP-1)受体激动剂(orforglipron衍生物)SYH2086签订独家全球许可协议,总交易金额20.75亿美元。Madrigal计划在2026年上半年开始临床开发。许可协议支持Madrigal的管线战略,为MASH开发创新的联合治疗,以其基础疗法Rezafra™(resmetirom)为基础。

根据协议,石药集团已授予Madrigal开发、制造和商业化SYH2086的全球独家许可。石药集团将获得1.2亿美元的预付款,如果实现了某些开发、监管和商业里程碑,则有资格获得高达19.55亿美元的里程碑付款,以及净销售额的特许权使用费。石药集团可能会根据某些条件在中国开发和商业化其他口服GLP-1激动剂。该交易预计将于2025年第四季度完成,但须经适用的监管部门批准。
TOP11
20.1亿美元:翰森制药&再生元
2025年6月2日,翰森制药与美国再生元(Regeneron)共同宣布一项重磅许可合作:再生元以8000万美元首付款、最高19.3亿美元里程碑付款获得翰森在研GLP-1/GIP双受体激动剂HS-20094全球独占许可(不含中国内地、香港及澳门)。

HS-20094是一款每周皮下注射的候选药物,在超过千例受试者的II期试验中展现出与礼来tirzepatide(全球唯一获批GLP-1/GIP双激动剂)相近的显著减重和安全数据,目前正于中国开展肥胖症III期和糖尿病2b期试验。
TOP12
20亿美元:联邦制药&诺和诺德
3月24日,联邦制药宣布其全资附属公司联邦生物科技已与诺和诺德(Novo Nordisk)达成UBT251的独家许可协议。诺和诺德将获得UBT251的全球(不包括中国大陆、香港、澳门和台湾地区 )的开发、生产和商业化权益,联邦生物将保留UBT251的中国权益。

根据独家许可协议并受其条款和条件约束,联邦生物将获得诺和诺德支付的2亿美元的首付款,最高达18亿美元的潜在里程碑付款,以及在中国内地(大陆)、香港特别行政区、澳门特别行政区和台湾地区外基于净销售额的分级特许权使用费。
UBT251是一款GLP-1/GIP/GCG三靶点受体激动剂,当前处于早期临床开发阶段,用于治疗肥胖、2型糖尿病及其他疾病。截至目前,UBT251已在中国获批开展针对成人2型糖尿病、超重或肥胖、代谢相关脂肪性肝病(MAFLD)和慢性肾脏病(CKD)的临床试验,并在美国获批开展针对成人2型糖尿病、超重或肥胖以及慢性肾脏病(CKD)的临床试验。联邦生物近期在中国大陆的超重和肥胖人群中启动了该产品的2期临床。
TOP13
19.7亿美元:恒瑞医药&默沙东
2025年3月25日,恒瑞医药宣布将Lpa小分子抑制剂HRS-5346的大中华区以外全球权益授权给默沙东。HRS-5346是一种在研的Lp(a)口服小分子抑制剂,目前正在中国进行Ⅱ期临床试验。

根据协议,恒瑞制药已授予默沙东在全球范围内开发、制造和商业化HRS-5346的独家权利,不包括大中华地区。恒瑞医药将获得2亿美元的预付款,并有资格获得与某些开发、监管和商业里程碑相关的里程碑付款,最高可达17.7亿美元,以及HRS-5346净销售额的特许权使用费(如果获得批准)。
TOP14
15.4亿美元:信诺维&安斯泰来
5月29日,信诺维医药宣布:与安斯泰来达成一项独家许可协议,授权其独家拥有 XNW27011 在全球(除中国大陆、香港、澳门和台湾地区外)开发和商业化的权利。

根据协议条款,信诺维将获得1.3亿美元的首付款,并有资格收取最高7000万美元的近期付款,以及最高可达13.4亿美元的与开发、注册、商业化相关的里程碑付款(总计15.4亿美元,约110.66亿人民币,按最新汇率1
美元 ≈ 7.1859 人民币计算)。此外,XNW27011获批上市后,信诺维还将获得该产品净销售额的特许权使用费。
XNW27011由信诺维研发,是新一代抗体偶联药物(ADC) ,靶点为 Claudin18.2 ,在 Claudin18.2 表达实体瘤(如胃癌、胰腺癌等)领域有良好抗肿瘤疗效 。2024年6月14日,XNW27011获美国FDA快速通道资格,用于治疗胃癌 。2025年7月10日,中国药物临床试验登记与信息公示平台显示,XNW27011登记了一项针对局部晚期或转移性胃/胃食管结合部腺癌患者进行的III期研究,旨在比较 XNW27011 和研究者选择的治疗在后线治疗胃或胃食管结合部腺癌的疗效。该试验拟在国内入组 375 人,研究的主要终点为无进展生存期和总生存期。
TOP15
12.4亿美元:石药集团&Radiance
2月19日,石药创新制药股份有限公司的控股子公司石药集团巨石生物制药有限公司与Radiance Biopharma达成协议,Radiance Biopharma将获得巨石生物自主研发的重组抗人类受体酪氨酸激酶样孤儿受体1(ROR1)抗体偶联药物SYS6005项目在一定区域范围内的开发和商业化等权利。

根据协议,Radiance
Biopharma将获得巨石生物自主研发的SYS6005项目在美国、欧盟、英国、瑞士、挪威、冰岛、列支敦士登、阿尔巴尼亚、黑山、北马其顿、塞尔维亚、澳大利亚和加拿大开发和商业化SYS6005的独家权利,并后续根据临床/商业供应协议获得生产该产品的独家权利。
巨石生物将获得1500万美元首付款;以及相应里程碑款项,其中开发里程碑款项累计不超过1.5亿美元,销售里程碑款项累计不超过10.75亿美元。总计不超过12.4亿美元(约90.27亿人民币,按最新汇率1 美元 ≈ 7.2796 人民币计算)。
SYS6005是一款单克隆抗体偶联药物,SYS6005 中的抗 ROR1 抗体能特异性地识别并结合肿瘤细胞表面的 ROR1 受体,随后通过细胞的内吞作用进入细胞内部。在细胞内的溶酶体作用下,药物中的毒素被释放出来,进而发挥杀伤肿瘤细胞的作用,达到治疗癌症的目的。SYS6005已于2024年12月在中国获批IND,拟定适应症为晚期肿瘤,预计适用于治疗血液肿瘤、卵巢癌、非小细胞肺癌等。

 产业资讯
产业资讯
 新药猎人笔记
新药猎人笔记  2025-11-24
2025-11-24
 50
50

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2025-11-24
2025-11-24
 52
52

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-11-24
2025-11-24
 51
51