 产业资讯
产业资讯
 医麦客
医麦客  2025-10-11
2025-10-11
 1454
1454
CAR-T 细胞疗法自 2017 年首次获得 FDA 批准以来,彻底改变了血液肿瘤的治疗格局,但基于 ex vivo(体外制备)的传统模式始终面临着难以逾越的产业化鸿沟。个体化生产流程导致治疗成本高达数十万美元,患者等待时间长达数周,且复杂的操作工艺使其仅能覆盖少数中心城市的患者。
in vivo(体内)CAR-T 细胞疗法的出现正是为了突破这些瓶颈,其核心优势在于无需体外分离 T 细胞,有望实现现货型(off-the-shelf)的治疗模式,且大幅降低生产成本,以及可避免清淋处理,提高治疗安全性。
近两年已成为 in vivo CAR-T 技术从概念验证迈向临床实践的关键转折点。当下全球已有超过 70 款 in vivo CAR-T 管线进入临床前或临床早期开发阶段,预计 2025 年底管线数量将突破 100 个。
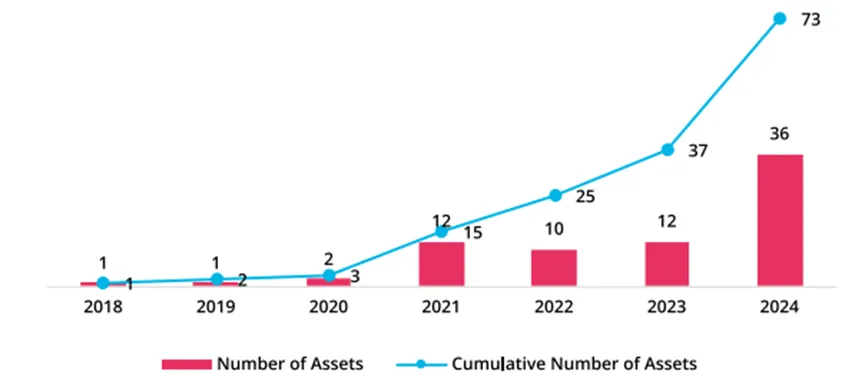
▲ in vivo CAR-T 细胞疗法管线年增长趋势
在 in vivo CAR-T 技术路线中,递送系统的选择至关重要。目前主要分为病毒载体(以慢病毒为主)和非病毒载体(以 LNP 为主)两类。其中 mRNA 与脂质纳米颗粒(LNP)的组合技术正逐渐成为非病毒递送系统的主流选择。与慢病毒等病毒载体相比,mRNA-LNP 组合具有更高的安全性、灵活性和更快的设计迭代速度等特点,将避免病毒载体可能带来的插入突变风险和长期毒性问题。
今年,业内发生了几起重大收购案,点燃了业内人士对 in vivo CAR-T 的关注。其中,最引人注目的是艾伯维以 21 亿美元高价收购 Capstan Therapeutics,一举拿下其基于 LNP 的 mRNA 递送技术平台。此外,阿斯利康以 10 亿美元重金收购 EsoBiotec,囊获其工程纳米抗体慢病毒(ENaBL)平台;吉利德旗下 Kite 公司以 3.5 亿美元将 Interius BioTherapeutics 收购,囊获其球首个进入人体临床试验的以慢病毒载体递送 CAR 转基因 in vivo CAR-T 细胞疗法。
值得注意的是,艾伯维对 Capstan 的估值是吉利德对 Interius 估值的 6 倍,这一差距或许正揭示了行业对 mRNA-LNP 和慢病毒载体路线对于 in vivo CAR-T 的价值的深刻认知。
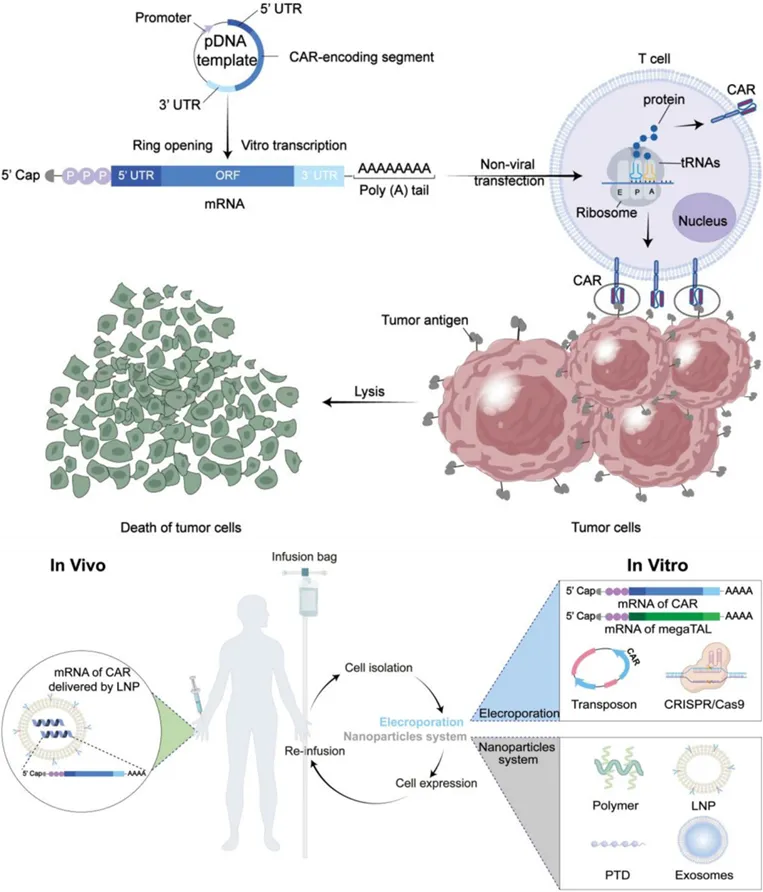
▲ 基于 mRNA 的 CAR-T 免疫疗法的原理及非病毒 CAR-T 细胞的产生
回顾 mRNA 技术的发展历程,从早期因稳定性差、免疫原性高而被质疑,到 2020 年新冠疫苗的成功商业化,其产业化应用已从传染病疫苗扩展到基因疗法、蛋白替代疗法和再生医学等多个领域。然而,mRNA 技术要在抗感染疫苗之外的更广泛治疗场景中实现规模化应用,仍面临三大核心瓶颈:递送效率低、生产工艺与质控难度大、表达时间短。
随着 in vivo CAR-T 赛道的升温,mRNA 技术能否借此东风突破自身产业化瓶颈?这不仅关乎两种前沿技术的协同发展,更将决定下一代细胞疗法能否真正实现「治疗民主化」的愿景——让先进细胞疗法摆脱对高端医疗中心的依赖,惠及更多患者群体。
产业化挑战与关键突破点
1、递送系统改造:突破肝脏富集局限
传统 LNP 静脉注射后约 90% 富集于肝脏,靶细胞递送效率不足 5%,严重限制其应用。近年来,行业通过表面修饰、脂质组成优化等多维度创新,逐步构建起靶向递送技术体系。
2018 年,mRNA 技术奠基人、宾夕法尼亚大学 Drew Weissman 教授团队在 Journal of Controlled Release 发表论文,率先提出将抗体片段融合到 LNP 表面的策略,通过化学偶联法(SATA-马来酰亚胺)将靶向血管内皮标志物 PECAM-1 的抗体修饰至 LNP 表面,实现肺部特异性 mRNA 递送。
2022 年,优卡迪在 Journal of Controlled Release 发表论文,阐述了表面负载 CD3 抗体修饰的 LNP 载体技术,通过 CD3 抗体介导靶向 T 细胞,在静脉注射后实现体内生成 IL-6 敲低的 CD19-CAR-T 细胞,为 in vivo CAR-T 的临床应用提供了新思路。
2022 年,CAR-T 之父 Carl June、Drew Weissman 和 Jonathan Epstein 等共同创立了 Capstan Therapeutics,进一步优化了 LNP 表面修饰策略,开发了 tLNP(靶向 LNP)用于 in vivo CAR-T 细胞疗法。其 tLNP 递送系统通过与抗体或抗体片段偶联,实现对特定细胞类型的靶向递送。紧接着,Capstan 将 tLNP 技术应用于其核心管线,在临床前研究中展现出显著效果。
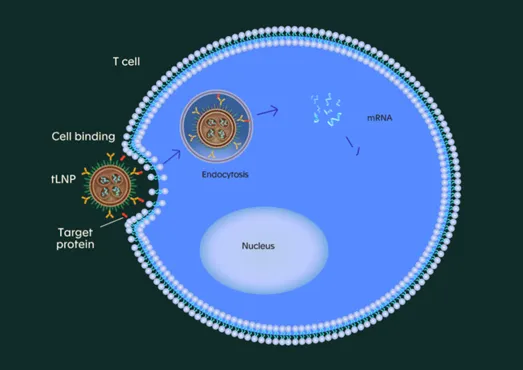
2025 年 6 月,Capstan 公司及宾夕法尼亚大学的研究人员在 Science 发表论文,显示开发了一种新型可电离脂质 L828,并优化了 LNP
配方降低肝脏积累。其通过在 tLNP 表面偶联 anti-CD5 抗体,进一步实现对脾脏中免疫细胞的特异性靶向。当月,Capstan 启动 CPTX2309 的
1 期临床试验,用于治疗 B 细胞介导的自身免疫疾病。随后不到半个月,Capstan 即被高价收购,凸显行业对 mRNA-LNP 路线的认可。
在企业推动临床转化的同时,学术界在脂质组成创新上取得突破。2025 年 4 月,上海交通大学霍云龙教授团队在 Nature Communications 发表文章,通过新型 LNP 递送 mRNA 生成瞬时 CAR-T 细胞,将胆固醇替换为等量的β-谷固醇以优化 LNP 脂质组成,显著提高 mRNA 表达效率,同时在 LNP 表面偶联 CD5 抗体,使其具备特异性靶向 T 细胞的能力。在肺纤维化模型中,单次给药即可实现活化成纤维细胞的特异性清除,促进肺泡上皮再生,年轻和老年小鼠的纤维化区域显著减小。值得注意的是,该疗法采用瞬时表达策略,CAR-T 细胞在完成纤维化逆转后自然消退,避免了长期存在的 CAR-T 细胞可能导致的脱靶风险。
当前行业正从单一靶向策略向多维度精准递送发展,包括优化 LNP 脂质组成、SORT-LNP 技术、可裂解脱 PEG 的 LNP 减少「加速血液清除」效应等。
2、生产工艺的规模化升级与质控体系建设
将 mRNA-LNP 生产工艺从实验室推向商业化,面临着一致性与稳定性的严峻挑战。该过程涵盖质粒构建、体外转录(IVT)、LNP 包封、纯化、灌装等多个复杂环节,其中 LNP 的包封率、粒径分布、稳定性等关键质量属性(CQA)的控制仍是行业难题。针对这些挑战,行业在工艺标准化、连续化生产和质量控制方面取得了一些共识。
2023 年, BioPhorum 联盟发布 mRNA-LNP 产品的行业共识,为其开发与生产提供 CQA 指导。下表汇总了核心 CQA 内容,供大家参考。
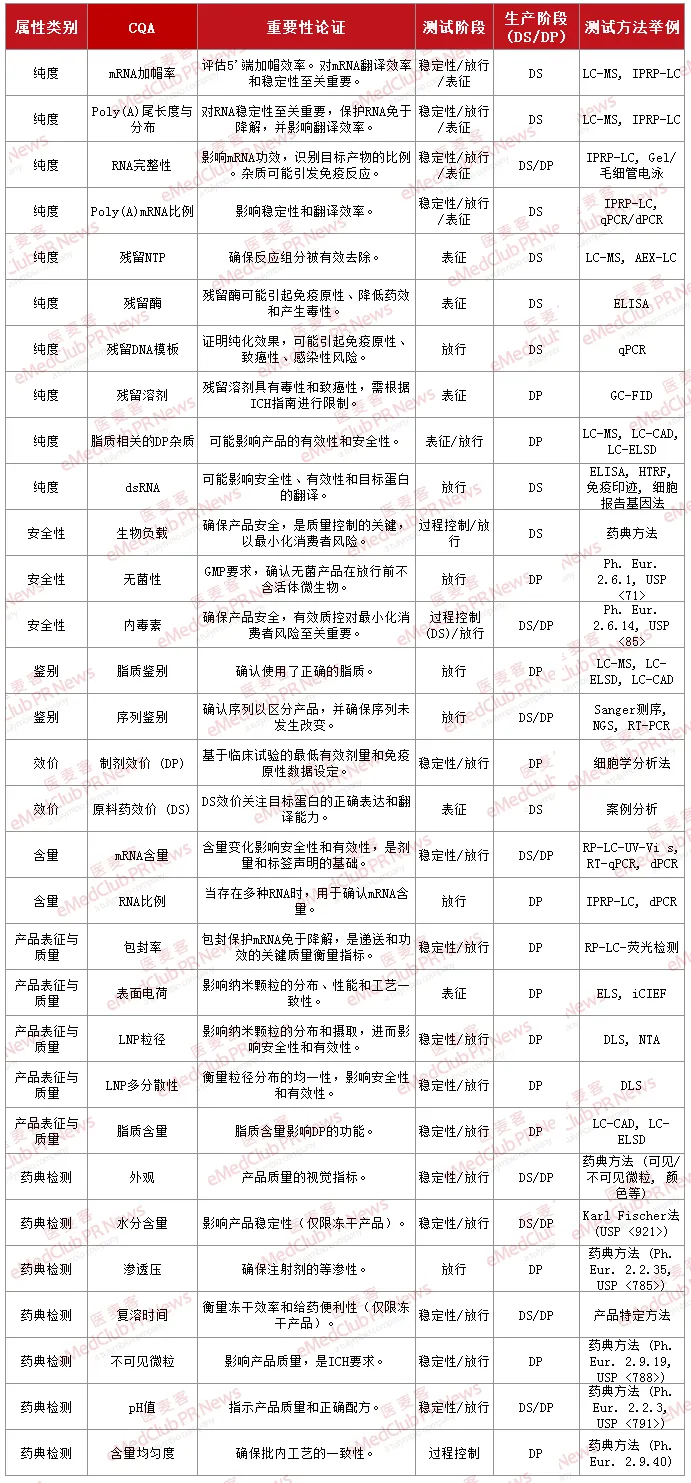
▲ mRNA-LNP 产品 CQA 清单
尽管 CQA 标准已清晰,但当前生产工艺仍存在产量低、质量波动大等问题,难以满足 in vivo CAR-T 疗法的商业化需求——mRNA 完整性控制依旧存在困难,与此同时难以精准控制 LNP 的包封率、粒径为之后 tLNP 的偶联制备增加挑战。为满足 mRNA-LNP 工艺开发与生产的 CQA 要求,Cytiva Fast Trak 推出针对性的平台化工艺解决方案,提供了从质粒 DNA 生产、IVT 反应、mRNA 纯化到 LNP 包封、纯化的端到端工艺解决方案。
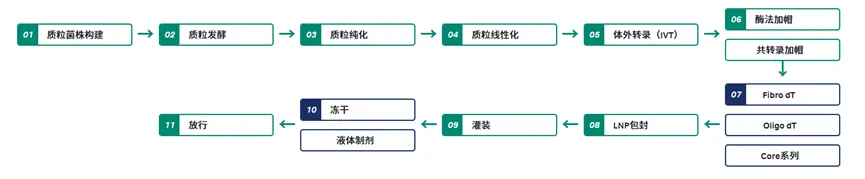
▲ Cytiva Fast Trak-mRNA 工艺路线
在工艺开发阶段即融入质量源于设计(QbD)理念,通过科学的实验设计(DOE)方法识别关键工艺参数(CPP)与 CQA 的关联,建立全面的过程控制策略,保障 mRNA 完整性超 85%,批产量高达 10 g/L 的 IVT 小试与放大工艺,且在不同批次中展现出高度一致性的批间稳定性。
在质控环节,结合 Oligo(dT) 亲和层析、切向流过滤(TFF)等手段获得符合临床要求的高纯度 mRNA 原液,同时通过优化 IVT 工艺参数与杂质纯化流程(如去除 dsRNA),有效降低 mRNA-LNP 产品的免疫原性。此外,Cytiva Fast Trak 高效检测平台能在一天内完成包封率、LNP 粒径分布、LNP 中 mRNA 完整性和 mRNA-LNP 空壳率等关键指标检测,助力和加速工艺开发。
在 mRNA-LNP 生产阶段,Cytiva Fast Trak 基于可放大的平台化工艺解决方案,助力客户实现高产量、高质量以及高稳健的 GMP 生产。项目交付结果显示,六批次 mRNA 包封平均 PDI 小于 0.05,并在包封率、空壳率以及粒径分布上保持高度一致性。
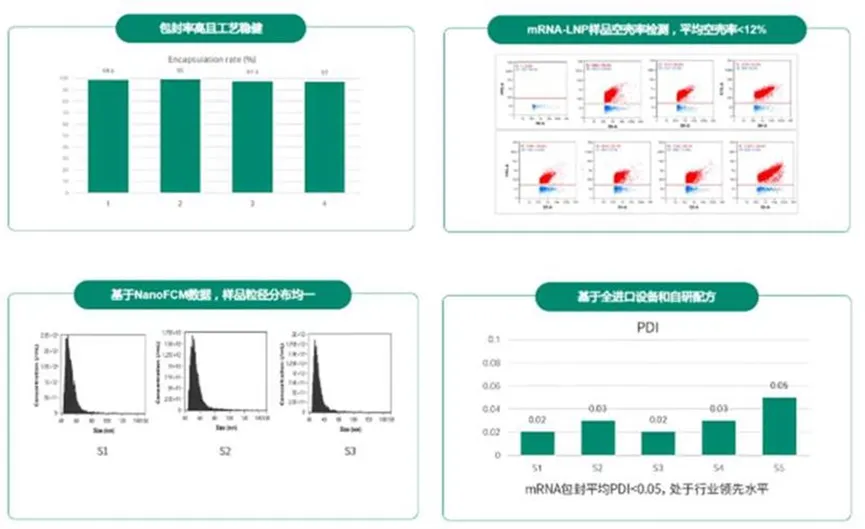
▲ Cytiva Fast Trak 的 mRNA-LNP 平台-优异的关键质量属性
这一系统性平台化化工艺解决方案不仅有效解决了 mRNA-LNP 生产中的关键瓶颈,还保障了产品质量,为监管审批提供了完整的数据支持,也为 in vivo CAR-T 的产业化提供了可靠的技术支撑。
3、mRNA 表达的持久性
mRNA 表达的瞬时性是一把双刃剑,一方面避免了基因组整合风险,另一方面也限制了 CAR-T 细胞的持久性。目前提升表达持久性策略包括优化 mRNA 序列——含 5'UTR、3'UTR 和 Poly(A) 尾的修饰,重复给药方案等。
这种「短暂性」在不同疾病治疗中各有利弊。对于肿瘤治疗,CAR 表达时间过短可能导致疗效不足;然而,对于自身免疫疾病,瞬时表达恰恰成为一种优势,使其能够实现「免疫重置」而非对免疫细胞进行长期或永久性清除。
正如博生吉创始人、董事长兼 CEO 杨林教授所言,「mRNA CAR-T 存活周期仅数天至数周,远低于慢病毒载体的长期甚至终身表达,虽可能影响肿瘤根治,却适配自免疾病『免疫重置』而非『持久杀伤』的需求。」
结语
mRNA 与 CAR-T 的结合,代表了细胞治疗领域的一次重大范式转变。mRNA 的快速设计能力完美匹配 CAR 分子迭代优化的需求,而 in vivo 模式为 mRNA 技术提供了突破递送壁垒的临床场景。
随着众多 MNC 的深度布局,行业正从分散的技术探索阶段迈向系统的产业化攻坚阶段。对于志在进入 in vivo CAR-T 这一领域的创新药企而言,能否快速建立成熟、稳定且可放大的生产工艺体系,已成为决定研发进度乃至成败的关键。Cytiva Fast Trak 等平台提供的工艺开发与生产解决方案,正通过其在工艺稳定性、可放大性与质控体系三大核心环节积累的优势,为企业提供关键支持,帮助应对从序列到 IND 申报的全链条挑战,为更快实现治疗方案的临床转化与产业化提供坚实保障。
可以预见,当高效合规的工艺为技术创新铺平道路,细胞治疗从「个体化定制」 向「通用型药品」的步伐将大大加快,治疗民主化的愿景也将随之加速实现。

 产业资讯
产业资讯
 新华网
新华网  2026-02-13
2026-02-13
 783
783

 产业资讯
产业资讯
 医曜
医曜  2026-03-27
2026-03-27
 40
40

 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2026-02-27
2026-02-27
 36
36