 产业资讯
产业资讯
 药时空
药时空  2025-11-05
2025-11-05
 863
863
2025年11月3日,据国家药品监督管理局(NMPA)官网显示,艾伯维的艾可瑞妥单抗注射用浓溶液(受理号JXSS2400100)和艾可瑞妥单抗注射液(受理号JXSS2400101)出现在药品通知件送达信息中,这意味着该产品的上市申请审批未通过,原因不详。

图1:NMPA公示的2025年11月3日药品通知件送达信息
一般来说,药品通知件送达信息指药品审评过程中,国家药品监督管理局向行政相对人(如药品生产企业)发送的正式通知文件。若药品顺利通过审评,会收到“药品批准证明文件送达信息”;若未通过,则发送“药品通知件”说明原因。“药品通知件”通常是指审批未通过的通知文件,如《审批意见通知件》,会说明不予批准的理由。
据悉,一般通知件会说明未批准的原因,可能是技术审评未通过、补充资料不符合要求、现场检查发现问题等。申请人可以根据反馈进行补充研究或调整申请策略。因此,收到“药品通知件”并不一定意味着药物上市的彻底失败,理论上存在完善补充数据之后继续申报流程的可能性。
此前,艾伯维已向国家药品监督管理局药品审评中心(CDE)递交了4项艾可瑞妥单抗的上市申请并获受理,其中两项即为上述出现在药品通知件送达信息中的两项,另外两项则于2025年9月23日获CDE受理,受理号为JXSS2500127和JXSS2500128。至此,其所覆盖的适应症数量刚好与全球已获批或正在申报的适应症数量相当了。
艾可瑞妥单抗(Epcoritamab)是一款CD20×CD3双抗,可同时与T细胞上的CD3和B细胞上的CD20结合,并诱发T细胞介导的淋巴瘤B细胞杀伤。该药物最初由Genmab公司利用DuoBody技术平台开发。2020年6月,艾伯维与Genmab达成39亿美元合作协议,联合开发包括Epcoritamab在内的三种下一代双抗产品,双方共同负责日本和美国的商业化责任,而艾伯维负责进一步的全球化开发。
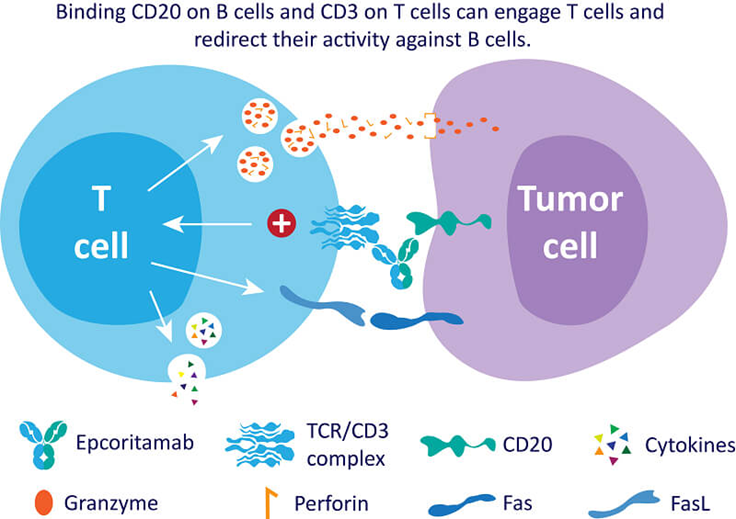
图2:艾可瑞妥单抗的作用机制(来源:艾伯维官网)
2023年5月,FDA批准艾可瑞妥单抗上市。目前,该药物已在美国、欧盟、日本获批上市,适应症涵盖弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、原发纵隔大B细胞淋巴瘤。今年5月初,Genmab向FDA递交新适应症的上市申请,用于联合来那度胺+利妥昔单抗(商品名:美罗华)治疗至少一种全身治疗的复发性/难治性滤泡性淋巴瘤(R/R FL),并获优先审评,PDUAC时间2025年11月30日。
8月7日,Genmab在其官网宣布了III期EPCORE®FL-1试验的积极结果,该试验旨在评估皮下注射双特异性抗体Epcoritamab联合利妥昔单抗和来那度胺(R2)治疗复发或难治性(R/R)滤泡性淋巴瘤(FL)成年患者的疗效。结果显示,Epcoritamab联合利妥昔单抗和来那度胺(R2)治疗复发/难治性滤泡性淋巴瘤(FL)患者,与单独使用R2方案相比,其总缓解率(ORR:95.7%,p<0.0001)和无进展生存期(HR 0.21,p值<0.0001)均显著改善。
在市场表现方面,2024年,艾可瑞妥单抗全球销售额达2.81亿美元,成为艾伯维在血液肿瘤领域的核心增长产品之一。今年上半年收入1.21亿美元,同比去年同期增长92.1%。
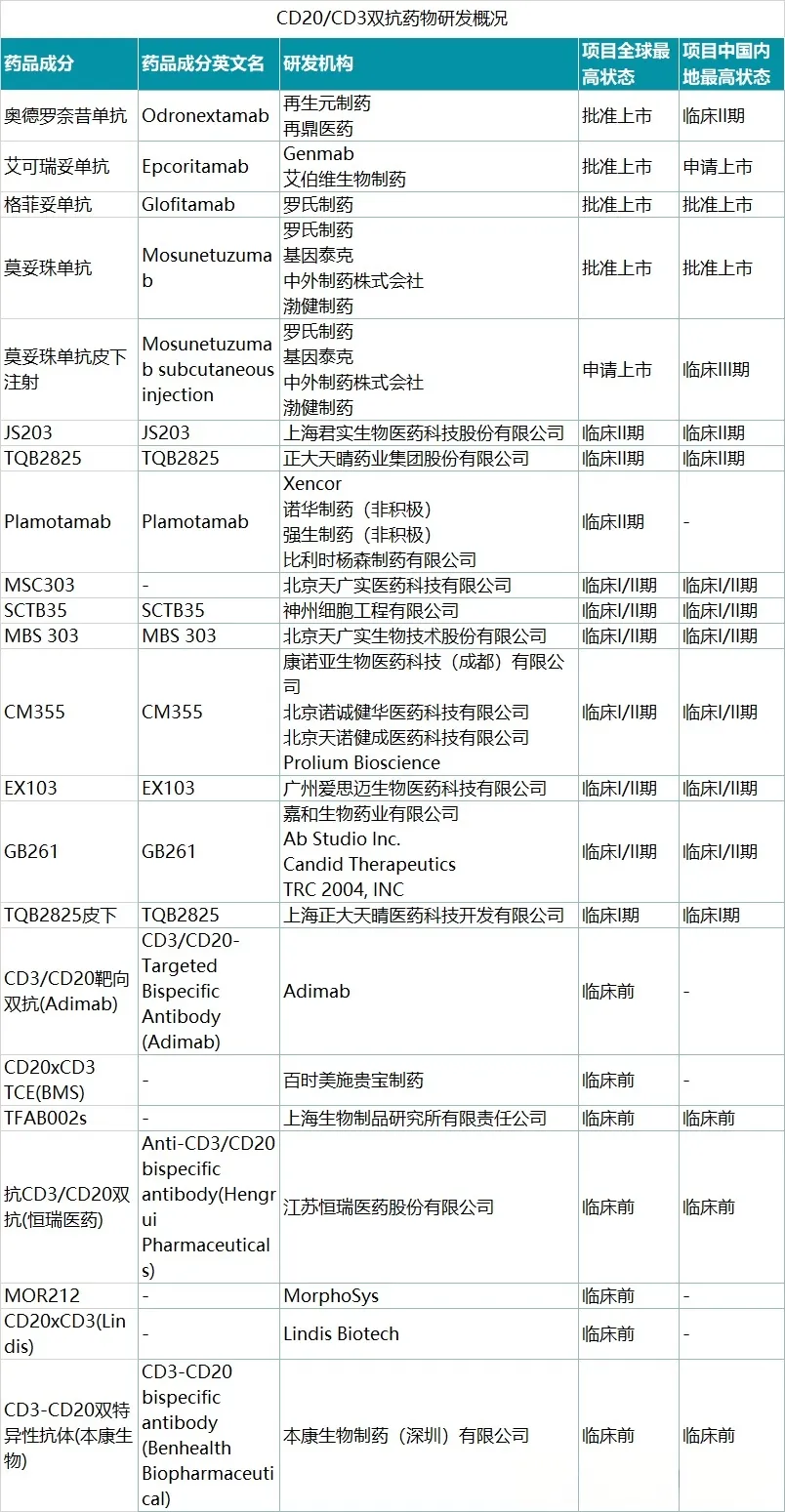
据了解,全球范围内现共有4款CD20×CD3双抗获批,除了艾伯维/Genmab的艾可瑞妥单抗外,其他三款产品分别为罗氏/渤健的莫妥珠单抗、罗氏的格罗菲妥单抗、再生元/再鼎医药的奥德罗奈昔单抗。在国内,目前仅有莫妥珠单抗和格罗菲妥单抗获批上市。
表1:全球CD20×CD3双抗赛道管线(来源:凯莱英药闻)

 产业资讯
产业资讯
 药智数据
药智数据  2026-02-12
2026-02-12
 27
27

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2026-02-12
2026-02-12
 26
26

 产业资讯
产业资讯
 bioSeedin柏思荟
bioSeedin柏思荟  2026-02-12
2026-02-12
 23
23