 研发追踪
研发追踪
 佰傲谷BioValley
佰傲谷BioValley  2025-11-07
2025-11-07
 685
685
一直以来,持久性问题被认为是通用CAR-T最大的挑战之一。在过去几年里,小编也报道过不少通用细胞管线的持久性存疑。
而最近,美国Caribou Biosciences公司在一项早期临床中,证明其同种异体CAR-T细胞Vispa-cel (CB-010)的疗效与持久性与自体CAR-T细胞疗法相当。
——Caribou似乎找到了解决通用CAR-T持久性问题的方法。
逆转高复发和低持久
Vispa-cel(Vispacabtagene regedleucel,以前被称为CB-010)是一种基于CRISPR基因编辑技术的同种异体CD19 CAR-T细胞;敲除了TRAC基因之外还额外敲除了PD-1,旨在通过限制CAR-T细胞过早耗竭来增强CAR-T细胞活性;Vispa-cel正在评估用于治疗复发/难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)。目前,美国FDA已经授予Vispa-cel用于治疗B-NHL的再生医学先进疗法(RMAT)、孤儿药和快速通道称号。
实际上,Vispa-cel是一款较早进入临床的通用CAR-T,最早临床登记可以追溯到2021年5月。
早在2022年6月,其开发公司Caribou就公布过CB-010针对r/r B-NHL的1期临床数据,但该早期数据令人失望。
当时数据显示,5名可评估患者中,总缓解率(ORR)达到100%,完全缓解率(CR)达80%;但50%的患者在六个月内复发——高肿瘤复发率和低疗效持久性使得CB-010和Caribou一度陷入质疑声中。
后续在2023年更新的数据中显示:16名可评估患者中,ORR为94%,CR为69%,≥6个月的CR率为44%;即有4名患者在获得CR后的六个月内复发——持久性仍然不太乐观。
然而在Caribou最新公布的数据中,该公司声称在1期研究ANTLER试验确认队列中,Vispa-cel展示出的疗效和持久性与自体CAR-T细胞疗法相当;在Vispa-cel优化队列中,Vispa-cel具有更持久的效果。这一结果直接逆转了CB-010最初的印象。
根据报告,解决Vispa-cel持久性问题的原因,则是Caribou对Vispa-cel进行了多种因素的优化,包括2+ HLA匹配和供体来源年轻化。
12个月的PFS为51%
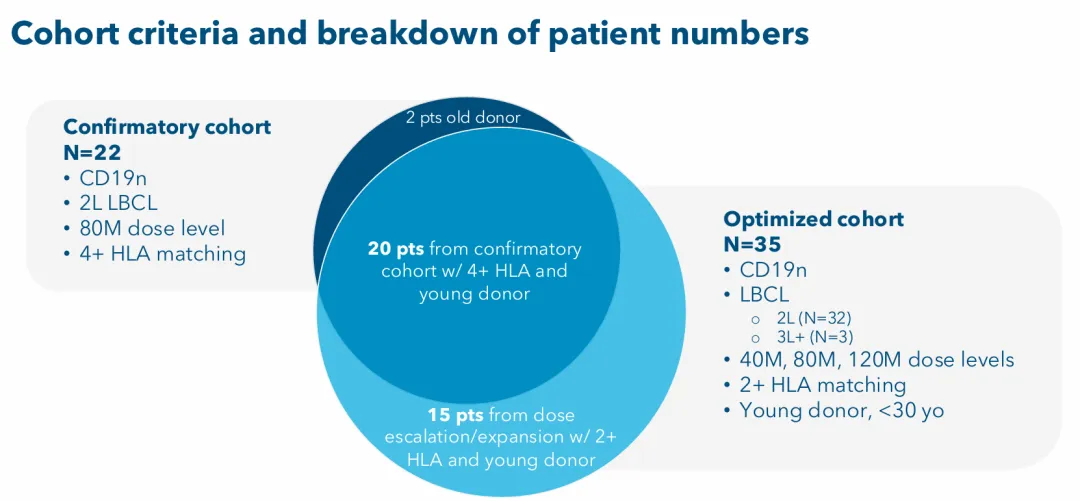
截至2025年9月2月的安全数据截止日期,ANTLER试验已招募了84名患者,其中包括一个确认队列,该队列由22名初次接受CD19抗原治疗的2L LBCL患者组成。该队列患者人类白细胞抗原(HLA)匹配≥4个匹配的HLA等位基因(4+ HLA匹配),剂量为推荐2期剂量(RP2D;80×10⁶ CAR-T 细胞)。
图片来源:参考资料1
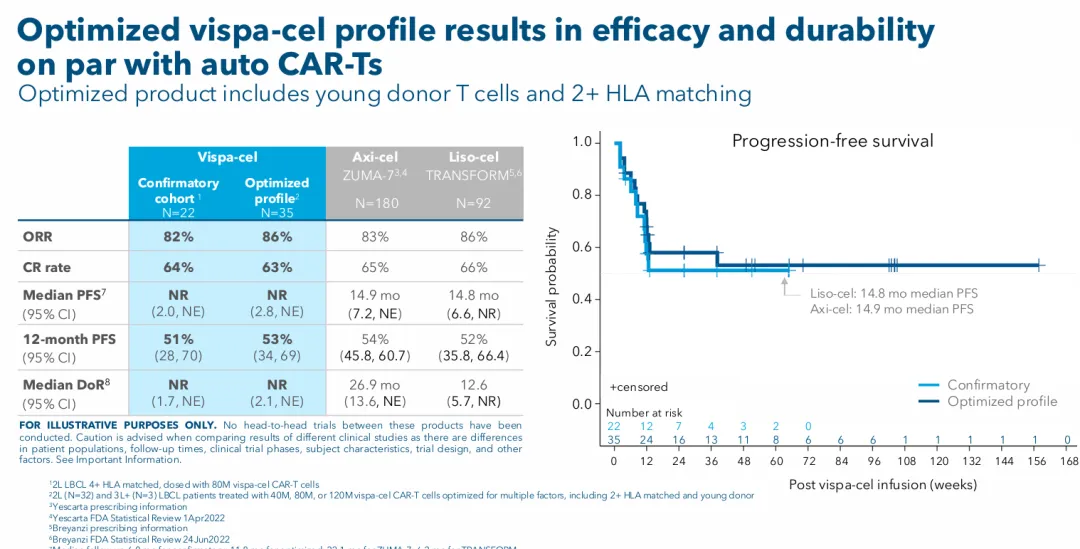
确认队列的数据证实,单次剂量的Vispa-cel治疗效果与获批的自体CAR-T细胞相当;包括ORR为82%,CR为64%,12个月无进展生存期率(PFS)为51%。
图片来源:参考资料1
另外,在ANTLER研究中还有一个Vispa-cel优化队列,该队列的Vispa-cel经过优化调整其细胞来源供体更年轻,另外部分HLA匹配≥2个等位基因(2+ HLA匹配)。
该Vispa-cel优化队列中,入组了35名CD19初治LBCL患者(其中32名患者为2L治疗,3名为3L+)。该优化队列中,35名患者中的20名被纳入确认队列,其余15名被纳入剂量递增或扩展。
Vispa-cel优化队列的数据进一步证实,Vispa-cel的疗效和持久性与自体CAR-T相当。Vispa-cel优化队列的中位随访时间为11.8个月,截至2025年9月29日,Vispa-cel优化队列数据显示:ORR为86%,CR为63%,12个月的PFS为53%;其中一名患者在Vispa-cel治疗后3年处于完全反应状态。
另外,在所有接受治疗的患者中(N=84),Vispa-cel表现出总体耐受性良好,其安全性数据支持其可用于门诊环境使用。
基于以上数据,Caribou公司计划未来几个月内完善我们的关键试验设计,遵循FDA关于2L LBCL的随机对照3其试验的建议,并与FDA紧密合作,以实现全面注册的监管途径。
另一通用CAR-T数据也不错
Caribou公司在经过多轮的裁员和管线删减之后,只保留了两大核心管线——Vispa-cel和CB-011。在Vispa-cel取得较为积极的数据之后,CB-011发布的首次人体数据也颇为亮眼。
CB-011是一款靶向BCMA的通用CAR-T疗法,用于治疗多发性骨髓瘤。值得注意的是,辉瑞曾在2023年为Caribou提供2500万美元股权投资,旨在推进这条管线的临床开发。

图片来源:参考资料1
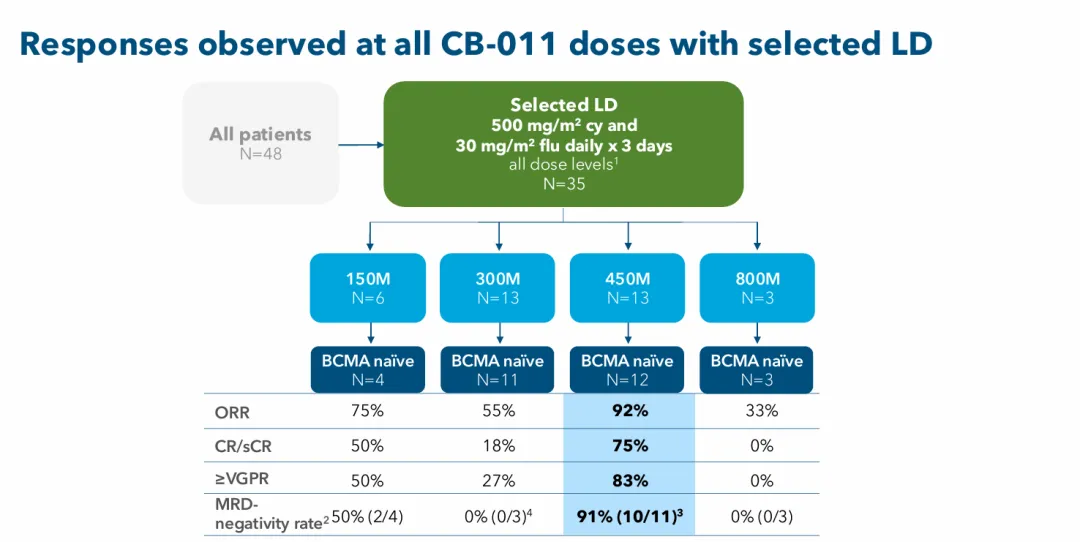
在1期试验CaMMouflage的剂量递增部分中,12名BCMA初治的r/r MM患者接受了450×10⁶ CAR-T细胞的推荐扩增剂量(RDE)的CB-011输注;接受RDE给药的患者中位随访时间为8.3个月,反应时间最长的患者在输注后15个月仍处于严格的完全缓解(sCR)。
截至2025年9月24日,RED队列的12例患者中,ORR为92%(11/12),CR为75%(9/12),91%的患者达到微小残留病(MRD)阴性。
值得注意的是,该早期数据初步报告了CB-011具有良好的持久性。截至数据截止日期,12名患者中有7名接受单剂CB-011治疗后在6个月或更长时间保持非常好的部分缓解。
但Caribou公司并未披露CB-011是否也是采用年轻供体来源的T细胞。
小结
尽管跨试验比较存在一定的误差和不准确性,但是在Vispa-cel(ANTLER)与Axi-cel(ZUMA-7)和Liso-cel(TRANSFORM)对比中,确实显示其ORR、CR和PFS数据相当。
不过,Vispa-cel的ANTLER样本量还是太少,期待后续数据。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 22
22

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 20
20

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 20
20