 产业资讯
产业资讯
 生物制药进展杂评
生物制药进展杂评  2025-11-13
2025-11-13
 250
250

过去十年间,中国生物制药行业在政府政策推动下实现转型,这些政策旨在支持创新并推动药物发现、开发和审批流程的现代化。中国生物制药企业借助政策红利,构建了抗体偶联药物(ADCs)、双特异性及多特异性抗体等尖端疗法的研发平台。
在此,我们对比了中国与美国及欧洲在“增强型”抗体疗法开发上的趋势,尤其是过去十年间(2015–2024年)的进展。研究聚焦于首次临床研究、全球首批获批、临床成功率以及两地开发分子的特征(详见补充信息)。分析数据来自公开渠道,并与Beacon ADC和Bispecific模块的数据进行了交叉验证。
临床研究的启动和全球首批获批情况趋势
抗体偶联药物(ADC)和多特异性抗体是极具创新性的药物,与传统单克隆抗体(mAb)相比功能更强大。中国近期对政策驱动创新的重视,包括增加研发投入、提升制造业水平以及提高临床试验效率,使得自2020年以来进入临床研究的中国公司改良抗体数量大幅增加(图1a)。事实上,中国公司开发的临床阶段改良抗体数量现已超过美国和欧洲公司的总和。
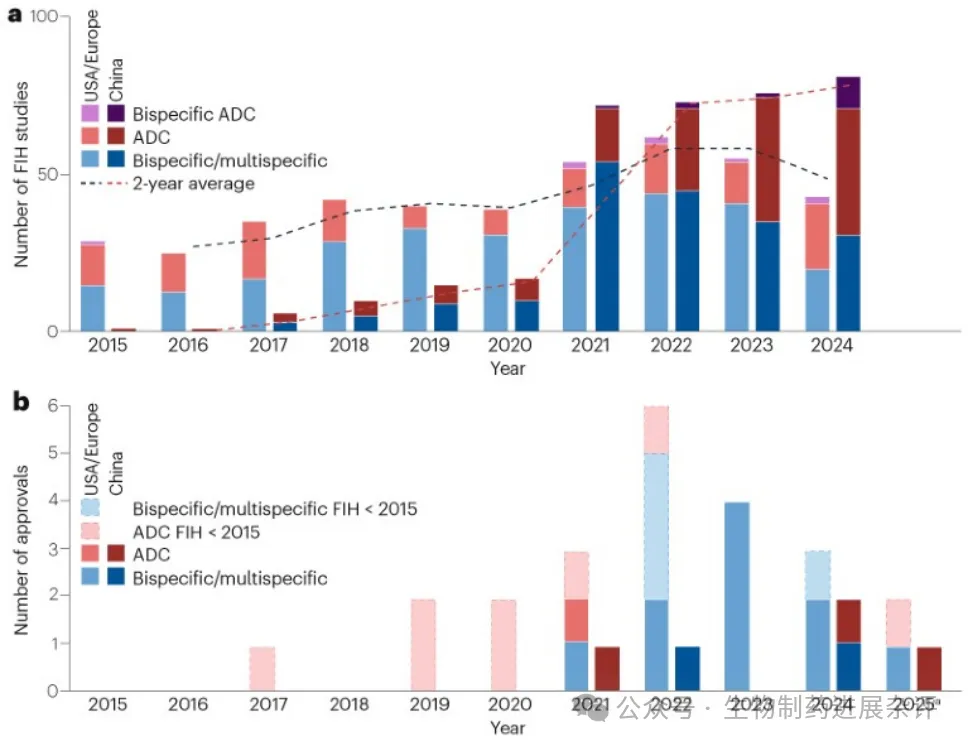
图1 |
基于中国、美国或欧洲企业的增强型抗体疗法首次临床研究及全球获批趋势。a:增强型抗体首次人体(FIH)研究趋势n= 776)在2015–2024年期间进入临床研究的分子,按分子来源地区(美国或欧洲)分层n= 424;
中国,n= 352)并按一般分子类别分类。b:2015–2025年间获批的增强型抗体的首次全球批准趋势a截至2025年9月1日,并按分子来源地区和一般分子类别进行分层。增强型抗体包括双特异性和多特异性抗体、双特异性免疫偶联物、抗体-药物偶联物(ADCs)及双特异性ADCs。欧洲地区包括欧洲经济区国家、英国和瑞士。
由于临床试验和监管审批流程很少短于5年,截至2025年8月,我们的数据集中仅有16种增强型抗体疗法(12种双特异性抗体和4种ADC)获得上市批准,其中大多数(11种,69%)源自美国或欧洲公司。考虑到所有增强型抗体的获批情况(即不考虑临床试验开始的年份),2015年1月1日至2025年8月31日期间共批准了28种增强型抗体疗法(16种双特异性抗
临床成功率比较
我们计算了增强型抗体疗法的临床阶段转化率和审批成功率,重点分析了抗癌疗法,因为数据集中近90%的分子针对癌症且不同治疗领域的成功率存在差异。研究结果仅为初步结论——由于中国原创开发的分子大多在2020–2024年间进入临床研究,目前大多数分子尚未确定最终结局(获批或终止)。
截至2025年8月,该组分子中仅有一种(trastuzumab rezetecan)获得批准。然而数据显示,与美国或欧洲公司研发的抗体疗法相比,中国企业开发的增强型抗体疗法在临床开发各阶段终止研发的可能性更低,最终总体获批率分别为57%和15%(图2a)。当这些队列的数据按格式分层时,我们的结果表明,中国原创的抗体偶联药物(ADCs)和多特异性分子均显著优于美国或欧洲公司开发的同类产品(图2b)。这些成功率尚需在未来通过进一步临床评估加以确认,以便企业能确定更多分子的最终研发结局。
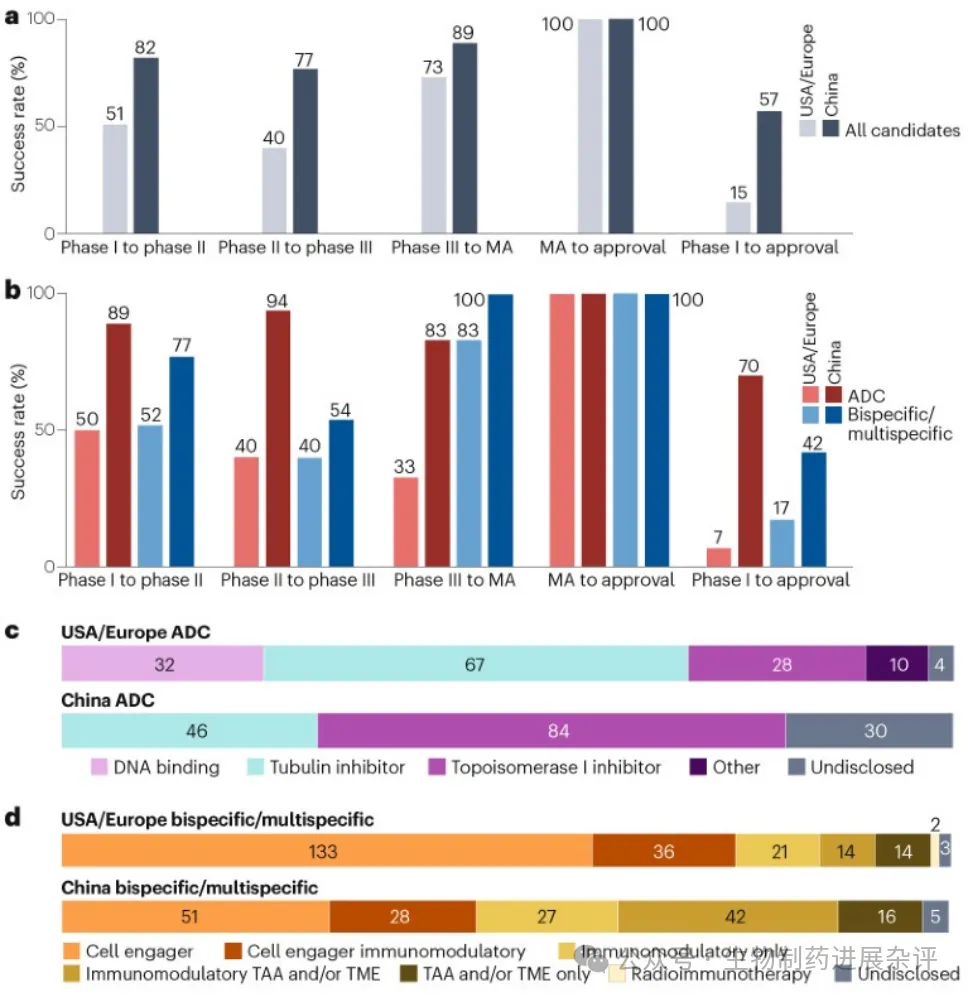
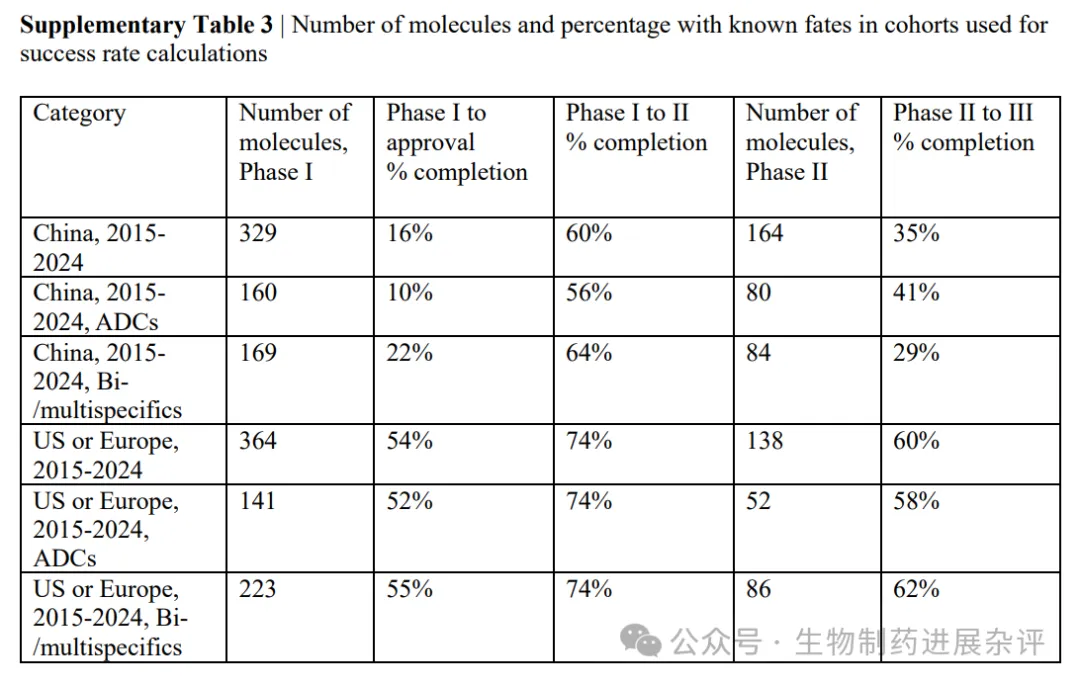
图2 |
中国与美国或欧洲企业开发的抗癌增强型抗体疗法的临床成功率及类型对比。a2015-2024年间进入癌症首次人体研究(FIH)的增强型抗体的阶段转化率及I期至批准成功率,按分子来源地区分层。b2015-2024年间进入首次人体(FIH)研究的增强抗体在癌症领域的各阶段转化率及I期至获批成功率,按分子来源地区和广义分子类别分层。增强抗体包含双特异性及多特异性抗体、双特异性免疫偶联物、抗体偶联药物(ADCs)和双特异性ADCs(后者归入ADC类别)。c基于中国、美国和欧洲公司开发的用于癌症治疗的ADC药物有效载荷作用机制分布。d,
Distribution of the mechanism of action of bispecific and multispecific
antibodies developed for cancer by companies based in China and the USA or
Europe. MA, marketing application; TAA, tumour-associated antigen; TME, tumour
microenvironment.
开发新产品作用机制和结构的趋势
我们的数据显示,中国企业越来越注重为抗癌抗体药物开发创新形式。例如,2024年进入临床试验的中国原创双特异性ADC药物比例高于欧美企业(中国12%;欧美5%)。
此外,ADC载荷的分布显示,与美国或欧洲公司研发的ADC相比,中国ADC中缺乏成熟的DNA结合型载荷,而较新型的拓扑异构酶I抑制剂载荷占比较高(图2c)。此外,双特异性与多特异性抗体的总体作用机制分布存在差异:一方面是不具备免疫调节特性的成熟细胞衔接器(美国和欧洲公司开发的分子中占59%,中国公司开发的占30%),另一方面是兼具免疫调节特性且靶向肿瘤相关抗原和/或肿瘤微环境的创新型双特异性与多特异性抗体(中国占25%,美国或欧洲占6%)(图2d)。中国原研增强型抗体药物在临床阶段转化率高于欧美企业,可能与其在有效载荷、作用机制和分子结构上的差异有关。
我们的分析证明,中国近期对政策驱动创新的重视使当地企业在复杂抗体疗法的研发上超越了美国和欧洲的企业。因此,美欧在这一领域处于竞争劣势,而美国尤其难以应对,因为美国食品药品监督管理局、国立卫生研究院等关键政府机构近期缩减了人员编制,并削减了科学项目的资金。
生物制药行业越来越注重开发抗体偶联药物(ADCs)和多特异性抗体疗法,因为它们相对于单克隆抗体(mAbs)具有更强的功能性。2015至2024年间,全球共有29种增强型抗体疗法(17种双特异性抗体和12种ADCs)获批上市(Supplementary Table 1 文末)。然而,未来十年(2025–2034)获批总量预计将大幅增加——2025年迄今已有三个获批,另有四个的上市申请正在评估中,近70个处于后期临床研究阶段(Supplementary Table 1,文末参考资料)。全球临床研发管线目前包含近500种增强型抗体疗法,其中超半数由中国企业研发。若当前态势持续,中国企业有望在未来五年内主导生物制药行业的抗体治疗领域。

 产业资讯
产业资讯
 新药猎人笔记
新药猎人笔记  2025-11-24
2025-11-24
 36
36

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2025-11-24
2025-11-24
 40
40

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-11-24
2025-11-24
 40
40