 研发追踪
研发追踪
 Bio Journey
Bio Journey  2025-11-17
2025-11-17
 564
564

01
核心提要
全新机制:诺和诺德的 Coramitug 是一种“清除剂”抗体,旨在通过免疫吞噬作用清除心脏中现有的淀粉样蛋白沉积,有别于现有的稳定剂和沉默剂。
喜忧参半:二期临床中,高剂量组显著降低了心衰生物标志物 NT-proBNP(-48%),但未能改善 12 个月时的 6 分钟步行距离(6MWT)。
坚定推进:诺和诺德认为 12 个月的观察期太短,已启动为期两年的三期临床试验 CLEOPATTRA。
尽管转甲状腺素蛋白介导的淀粉样变性心肌病(ATTR-CM)领域已有三款药物获批,赛道日益拥挤,但诺和诺德(Novo Nordisk)仍决心凭借其独特机制的新药杀入市场。
周一,在美国心脏协会(AHA)年会上,诺和诺德公布了其 ATTR-CM 候选药物 coramitug 的二期临床数据。结果显示:喜忧参半。
02
独特机制:从“减缓沉积”到“主动清除”
目前获批的 ATTR-CM 疗法主要分为两类:
稳定剂: 如辉瑞的 Vyndaqel/Vyndamax (Tafamidis) 和 BridgeBio 的 Attruby (Acoramidis),用于防止转甲状腺素蛋白错误折叠。
沉默剂: 如 Alnylam 的 Amvuttra (Vutrisiran),通过 RNAi 技术减少致病蛋白的产生。
这些疗法主要作用是减缓疾病进展,但无法清除体内已有的沉积物。
诺和诺德的 Coramitug 则另辟蹊径。作为一种“清除剂(depleter agent)”,它是一种单克隆抗体,旨在通过免疫系统的吞噬作用,主动清除患者心脏中现有的淀粉样纤维沉积。
诺和诺德首席科学顾问 Kees Hovingh 表示:“我们希望通过引入一种新的作用模式,为 ATTR-CM 患者带来附加价值。”
03
二期数据:标志物改善,功能未达标
这项二期试验招募了 104 名 NYHA II 或 III 级心力衰竭的 ATTR-CM 患者,评估了两种剂量(10 mg/kg 和 60 mg/kg)与安慰剂的对比。
“喜”在生物标志物
高剂量组(60 mg/kg): 与安慰剂相比,患者体内的 NT-proBNP(一种关键的心衰生物标志物)水平相对降低了 48%,具有统计学显著性。
低剂量组: 相对降低了 28%,未达到显著性。
“忧”在功能终点
在 12 个月时,两个剂量组均未能与安慰剂拉开显著差异。高剂量组比安慰剂组多走了 13.5 米,但无统计学意义。
安全性方面,该抗体耐受性良好。
04
行业对比:12个月功能终点是否过早?
诺和诺德这份“喜忧参半”的二期数据,尤其是 12 个月 6MWT 终点的失败,引发了业界的广泛讨论。为了更客观地评估这一结果,我们必须参考其竞争对手的关键三期临床数据:
Alnylam (沉默剂 - HELIOS-B研究)
Alnylam 的 Vutrisiran 在其关键性 HELIOS-B 三期研究中(数据截至30个月)取得了巨大成功。
生存获益:Vutrisiran 显著降低了全因死亡率和复发性心血管事件风险(主要终点,降低 28%)。
6MWT:在功能上,Vutrisiran 组在 30 个月时显示出 6MWT 获益(与安慰剂组相比有显著改善)。
NT-proBNP:在 30 个月时,Vutrisiran 组的 NT-proBNP 水平相比安慰剂组相对降低了 32%(在单药治疗组中降低了 43%)。
BridgeBio (稳定剂 - ATTRibute-CM研究)
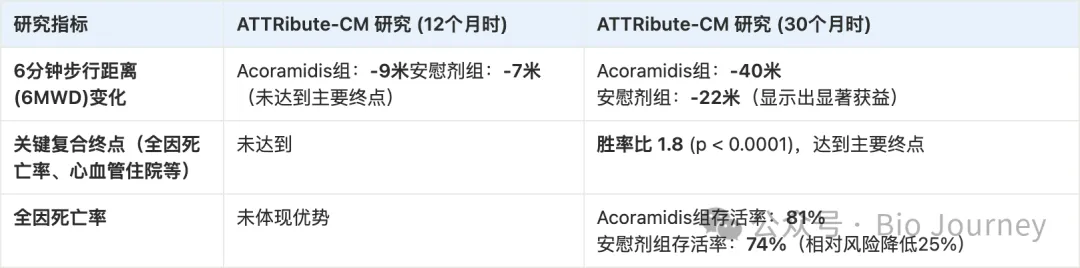
BridgeBio 的 Acoramidis 的数据尤其具有可比性。在其三期 ATTRibute-CM 研究中,该药物在 12 个月时评估 6MWT,结果与诺和诺德惊人地相似:未能达到主要终点(Acoramidis 组下降 9 米,安慰剂组下降 7 米)。
然而,该试验继续进行。到 30 个月时,Acoramidis 在包括全因死亡率、心血管住院、NT-proBNP 和 6MWT 在内的分层主要终点上,取得了高度统计学显著性的胜利。
辉瑞 (稳定剂 - ATTR-ACT研究)
作为该领域的“金标准”,辉瑞的 Tafamidis 在其三期 ATTR-ACT 研究中(数据截至30个月)显示:
生存获益:显著降低了 30% 的全因死亡率和 32% 的心血管相关住院率。
6MWT:Tafamidis 显著减缓了 6MWT 距离的下降(P<0.0001),在 30 个月时与安慰剂组拉开了显著差距。
NT-proBNP:在 30 个月时同样显示出显著改善。
05
为何仍要推进三期?
面对好坏参半的结果,诺和诺德决定基于整体数据继续推进。公司认为,二期试验中 12 个月的观察期可能太短,不足以显现功能性获益。
Hovingh 指出,在竞争对手(如辉瑞和 BridgeBio)更大规模的三期研究中,6MWT 的显著差异通常需要更长时间才能观察到(辉瑞药物需 18 个月,BridgeBio 药物需 30 个月)。
这一观点得到了竞争对手数据的有力支持。 正如上文对比所示,BridgeBio 的三期研究在 12 个月时 6MWT 同样“失败”,但在 30 个月时取得了成功。而 Alnylam 和辉瑞的阳性功能和生存数据,均是在 30 个月的观察期后获得的。
相比之下,诺和诺德 Coramitug 在短短 12 个月内展现出的 NT-proBNP 大幅下降(-48%),是一个非常积极的信号,这一降幅甚至优于 Alnylam 在 30 个月时的数据。
目前,Coramitug 的三期临床试验 CLEOPATTRA 正在招募患者。该研究将治疗时间延长至两年(104 周),并将继续评估症状评分和 6 分钟步行距离等终点。这款全新机制的“清除剂”能否在更长的时间里,将强劲的生物标志物改善(NT-proBNP)转化为实实在在的功能和生存获益,是 CLEOPATTRA 试验需要回答的核心问题。
Coramitug 是诺和诺德于 2021 年以 1 亿美元预付款从 Prothena 收购而来,后续里程碑付款最高可达 12 亿美元。此举也再次印证了诺和诺德在深耕糖尿病和肥胖症核心领域的同时,正积极向心血管等相关共病领域拓展。
原文:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 22
22

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 20
20

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 20
20