 研发追踪
研发追踪
 谈何容易
谈何容易  2025-11-17
2025-11-17
 624
624
2025 年 11 月 11 日,enGene Holdings 公布了其正在进行的 II 期试验 LEGEND 研究关键队列的初步数据,该试验旨在评估 detalimogene voraplasmid(也称为 detalimogene 或 EG-70)治疗高危、卡介苗(BCG)无应答的非肌层浸润性膀胱癌(NMIBC)伴有原位癌(CIS)患者(无论是否伴有乳头状病变)的疗效和安全性。

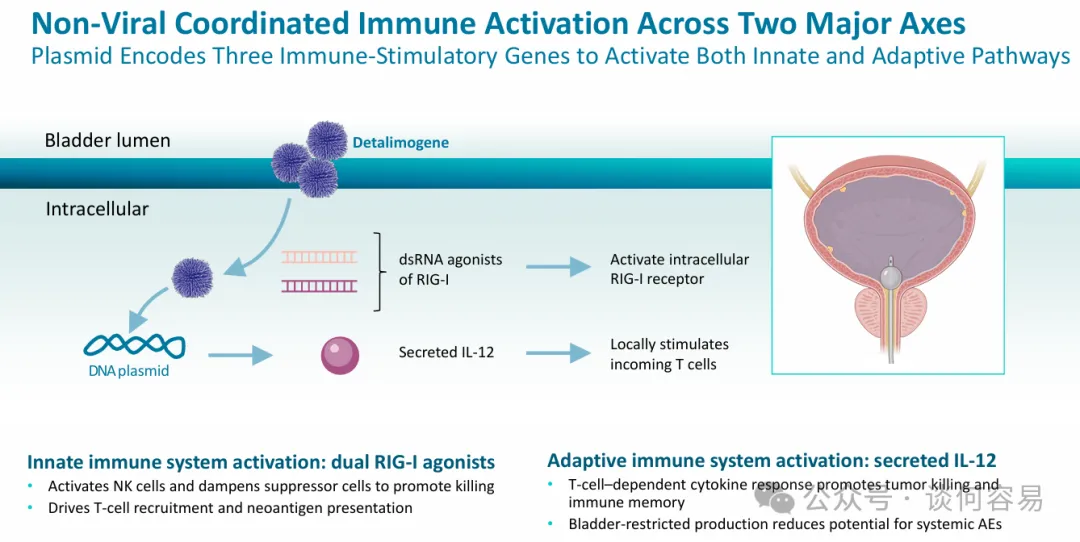
Detalimogene 是 enGene
开发的一款非病毒基因疗法,该疗法通过膀胱内灌注给药,以驱动膀胱局部表达先天性(RIG-I激动剂)与适应性(IL-12)免疫调节因子,并重塑肿瘤免疫微环境。
此次初步分析包括了 62 名患者在 3 个月时的数据以及 37 名患者在 6 个月时的数据。分析中的所有患者均依据 LEGEND
研究的修正方案进行评估,该修正方案于 2024 年第四季度生效,旨在使 LEGEND 研究更贴近美国泌尿外科学会的指南和标准护理。
根据修正方案入组且至少进行一次基线后疾病评估的 62 名患者数据显示:任何时间点的完全缓解(CR)率为 63%,3 个月时的 CR 为 56%,6 个月时的 CR 为 62%,其中 4 名患者在再次诱导治疗后成功转为完全缓解;所有完成 9 个月评估的 5 名患者均达到完全缓解。
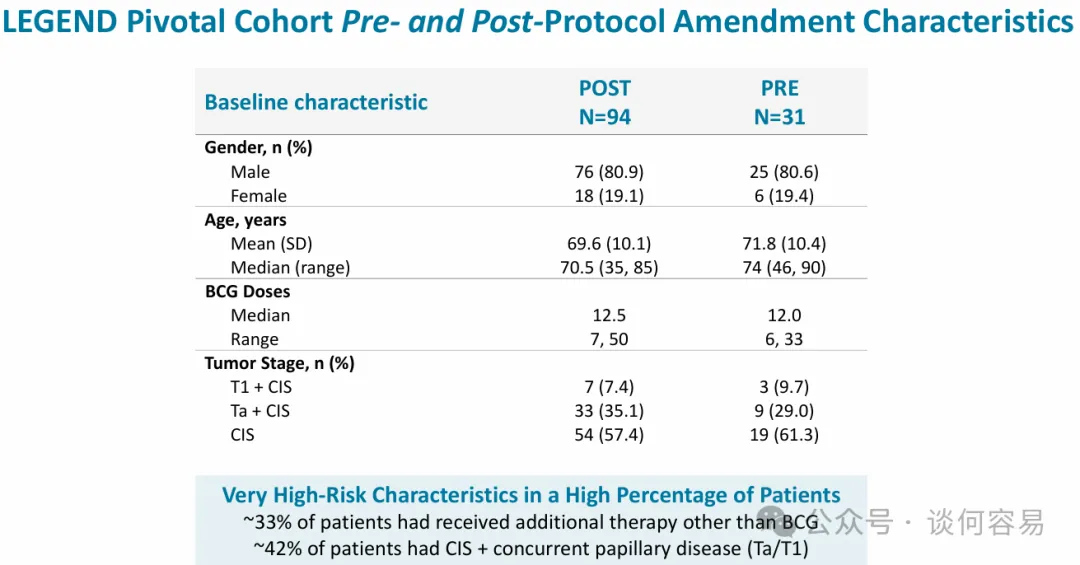
2024 年 9 月,enGene 报告了来自 LEGEND 研究关键队列中 21 名患者的初步数据,这些患者是实施方案修正前入组的。另有 10 名患者根据先前方案入组,总计 31 名患者。
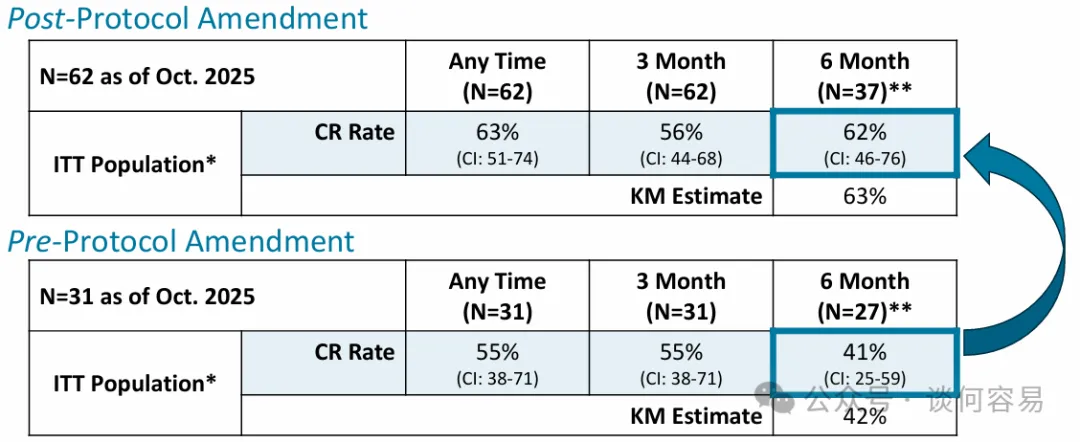
根据修正前方案入组患者的初步疗效数据显示,其 12 个月完全缓解率显著低于 FDA 已批准的针对 BCG 无应答 NMIBC
产品的相应数据。公司对修正后方案下入组患者初步 6 个月完全缓解率的强劲提升感到鼓舞。
经与 FDA 近期讨论后,关键队列的主要终点将从原定的 12 个月 CR,更改为任何时间点的 CR;其关键次要终点则改为 CR 患者的缓解持续时间(DOR)。此次更新的主要终点与 FDA 近期批准的其他项目保持一致。
目前,enGene 已完成关键队列 125 名患者的入组,超出目标 25%。
这些患者的数据显示出良好的耐受性特征:任何级别的 TRAE 为 42.4%,仅发生 3 例 3 级 TRAE,1.6% 的患者因 TREA
导致给药中断;0.8% 的患者因 TRAE 终止治疗。
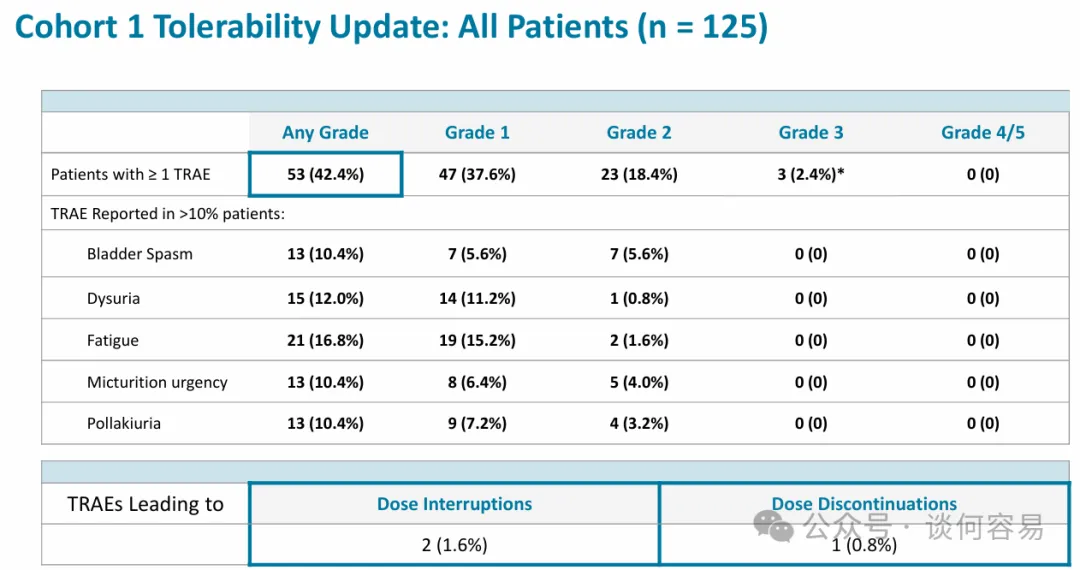
Detalimogene 的安全性数据显著优于目前已获批的疗法。
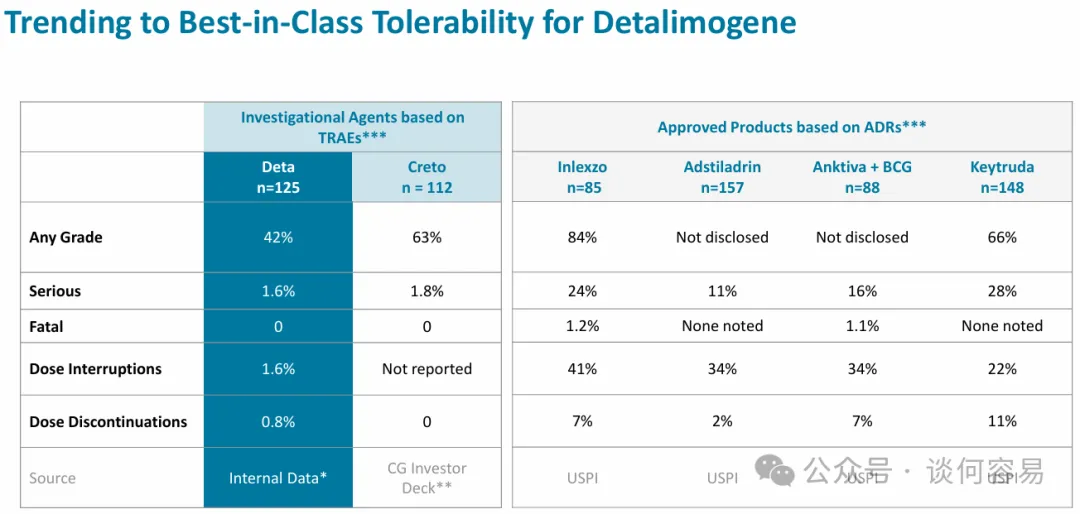
仅从疗效数据上对比,在主要终点任何时间点的 CR 率方面,Detalimogene 低于强生刚获批的吉西他滨膀胱内给药系统
INLEXZO(全球首创!强生膀胱癌新疗法获批上市,CR高达82%)和 CG Oncology 膀胱癌溶瘤病毒疗法 Cretostimogene,显著优于 K
药和腺病毒载体基因疗法 Adstiladrin。但 Detalimogene 的 6 个月时的 CR 率不输于任何疗法。

Detalimogene
虽然在疗效数据上相较强生略逊一筹,但凭借良好的安全性,若后续的完整队列数据依旧能保持目前的疗效,获批后将成为新的标准疗法。受此消息影响,enGene
美股在该交易日大涨近 47%,市值达 4.52 亿美元,足见市场对其的认可。

enGene 表示,在与 FDA 就统计分析计划达成一致并积累足够的 12 个月完全缓解率数据点后,预计将在 2026 年下半年提供 LEGEND
研究关键队列的数据更新。公司继续预计在 2026 年下半年提交 BLA,并有可能在 2027 年获得 FDA 批准。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 22
22

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 20
20

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 20
20