 研发追踪
研发追踪
 药时空
药时空  2025-11-19
2025-11-19
 1623
1623
11月17日,据国家药监局政务服务门户官网显示,礼来的替尔泊肽注射液出现在药品通知件送达信息中,涉及四个受理号,包括JXHS2400108、JXHS2400109、JXHS2400110、JXHS2400111。这意味着该药新适应症的上市申请审批未通过。至于是官方拒绝批准,还是企业自行撤回,原因未知。
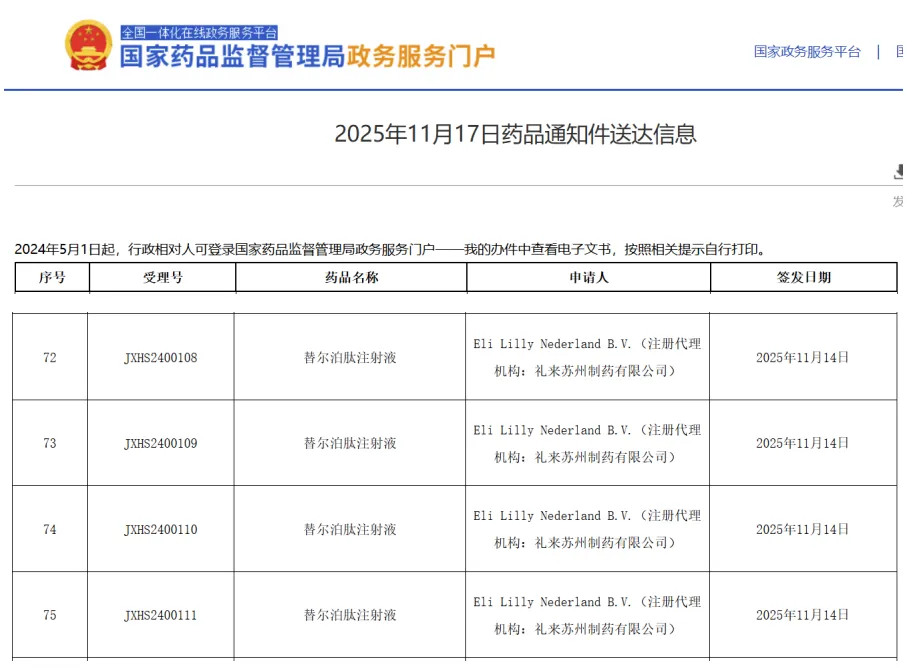
查询国家药品监督管理局药品审评中心(CDE)官网可知,上述四项受理号的承办时间为2024年12月14日,故推测适应症为射血分数保持的心力衰竭合并肥胖。据悉,该适应症美国报产时间是2024年11月16日,目前也还未获批。
替尔泊肽是一款GLP-1R/GIPR双重激动剂。SUMMIT研究是一项国际、双盲、随机、安慰剂对照试验,旨在观察替尔泊肽(Tirzepatide)对于肥胖心衰患者的心血管结局影响。《新英格兰医学杂志》同步在线发表了该研究。据2024年美国心脏协会科学会议(AHA)中公布的SUMMIT研究结果显示:
Tirzepatide组有36例患者(9.9%)和安慰剂组有56名患者(15.3%)死于心血管原因或发生心力衰竭恶化[风险比(HR):0.62;95%置信区间(CI):0.41~0.95;P=0.026]。Tirzepatide组有29例患者(8.0%)发生心力衰竭恶化,安慰剂组有52例患者(14.2%)发生心力衰竭恶化(HR:0.54;95%CI:0.3~0.85)。心血管原因死亡事件在Tirzepatide组和安慰剂组中分别有8例患者(2.2%)和5例患者(1.4%)(HR:1.58;95%CI:0.52~4.83)。
52周时,Tirzepatide组KCCQ-CSS的平均变化(±SD) 为19.5±1.2,而安慰剂组为12.7±1.3(组间差异:6.9;95%CI:3.3~10.6;P<0.001)。导致试验药物停药的不良事件(主要是胃肠道)发生在 Tirzepatide 组的 23 例患者 (6.3%) 和安慰剂组的 5 例患者 (1.4%) 中。
目前,替尔泊肽已在国内获批3项适应症:用于成人2型糖尿病患者的血糖控制、长期体重管理和阻塞性睡眠呼吸暂停。
除了上述未通过审批的适应症外,11月13日,CDE官网显示,礼来的替尔泊肽又一新适应症上市申请获受理,据悉,此为其第5项适应症在国内申报上市,推测该适应症为降低二型糖尿病伴心血管疾病风险增加的患者的主要不良心血管事件(MACE)的复合结局。
市场表现方面,据礼来发布的2025Q3业绩显示,公司的王牌产品替尔泊肽Q3销售额高达101.03亿美元,今年前三季度,总销售额高达248.37亿美元,预计全年有望超过350亿美元。远远超过默沙东K药的233.03亿美元,成为新的药王。
其两大核心产品线在Q3季度均展现出强劲增长势头:降糖版Mounjaro营收为65.15亿美元,同比增长109%;减重版Zepbound营收为35.88亿美元,同比增长185%,美国处方量占比达57.9%,超越诺和诺德。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 22
22

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 20
20

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 20
20