 研发追踪
研发追踪
 CPHI制药在线
CPHI制药在线  2025-11-21
2025-11-21
 813
813
2025年,国产创新药行业正迎来从“跟随创新”向“源头创新”的关键转折——多款处于临床阶段的管线,不仅在疗效数据上追平国际竞品,更在靶点选择、机制设计、人群覆盖等维度实现突破,展现出First-in-Class(FIC)或Best-in-Class(BIC)的全球竞争力。这些品种的临床进展,既为国内患者带来更优治疗选择,也推动中国创新药在全球市场的话语权提升。
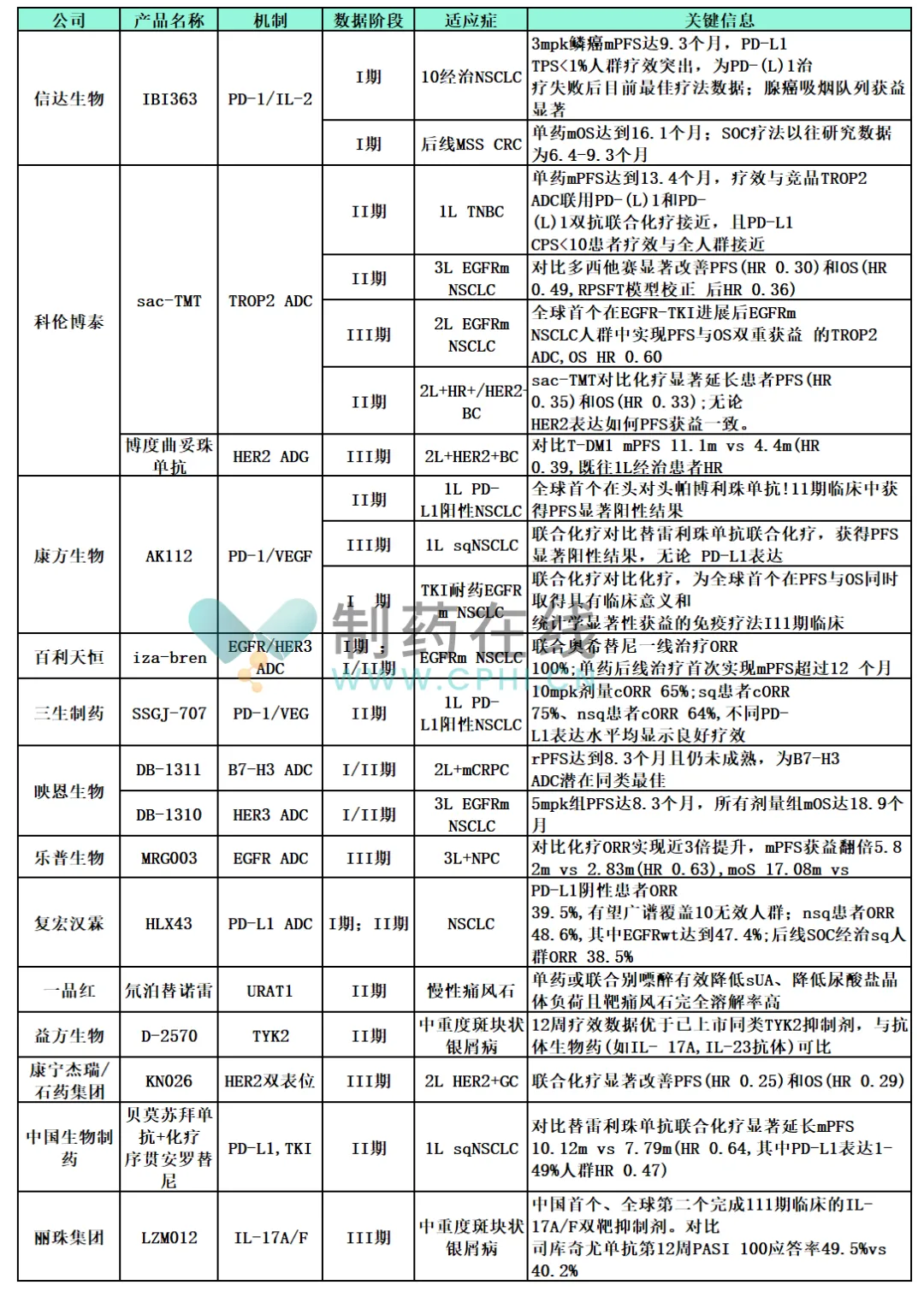
表格数据来源:中金公司研究部
1
PD-(L)1双抗:突破单药局限,重塑免疫治疗“全人群获益”格局
PD-(L)1抑制剂是肿瘤免疫治疗的基石,但传统单药存在两大短板:一是PD-L1低表达/阴性人群疗效有限,二是后线治疗响应率低。国产PD-(L)1双抗通过融合免疫激活、微环境调控等靶点,实现了“疗效扩群+毒性降低”的双重突破,部分品种已展现出超越国际同类的临床价值。
(1)康方生物AK112:PD-1/VEGF双抗的“全人群覆盖+单药活性”突破
康方生物的AK112(PD-1/VEGF双抗)是当前全球PD-(L)1双抗领域的“标杆品种”,其III期临床数据彻底打破了PD-(L)1抑制剂对高表达人群的依赖。在1L sqNSCLC(鳞状非小细胞肺癌)人群中,AK112联合化疗对比替雷利珠单抗联合化疗,中位无进展生存期(mPFS)达到10.12个月,较对照组延长2.33个月(HR=0.64);更关键的是,在PD-L1 TPS<1%的低表达人群中,AK112组mPFS仍达8.7个月,与全人群疗效(10.12个月)无显著差异,这是全球首个在PD-L1阴性人群中展现“联合化疗优效”的PD-(L)1双抗。
除联合方案外,AK112的单药数据同样惊艳:在1L PD-L1阴性NSCLC人群中,单药mPFS达到8.3个月,远超当前PD-1单药(TPS<1%人群mPFS通常不足5个月),甚至优于部分PD-(L)1联合化疗方案(如帕博利珠单抗联合化疗在低表达人群的mPFS约6.8个月)。其机制优势在于:VEGF通路抑制可改善肿瘤微环境的“免疫抑制性”——减少肿瘤血管的“渗漏性”,增加效应T细胞的肿瘤浸润,同时降低调节性T细胞(Treg)的比例,从而放大PD-1抑制剂的疗效。目前,AK112已启动全球多中心III期临床,目标是同步申报中美上市,有望成为首个实现“全人群覆盖”的PD-(L)1双抗。
(2)信达生物IBI363:PD-1/IL-2双抗的“后线低表达人群疗效突破”
信达生物IBI363(PD-1/IL-2双抗)是全球首个在PD-L1阴性人群中展现显著单药活性的PD-(L)1双抗,其1期临床数据为后线难治性NSCLC提供了新的治疗方向。在10经治NSCLC(接受过至少10线治疗)人群中,IBI363 3mpk剂量组的mPFS达到9.3个月,中位总生存期(mOS)达16.1个月,而当前后线标准治疗(SOC)的mOS仅为6.4-9.3个月,IBI363的疗效提升幅度超过70%。
更值得关注的是,IBI363在PD-L1 TPS<1%人群中的疗效与全人群一致——这一结果解决了PD-(L)1单药的核心痛点。传统IL-2因系统毒性(如毛细血管渗漏综合征)难以临床应用,而IBI363通过PD-1靶点的“肿瘤靶向性”,实现了IL-2在肿瘤微环境的富集:仅在PD-1阳性的肿瘤浸润淋巴细胞(TIL)表面释放IL-2,既增强T细胞的增殖与活化,又避免了系统暴露导致的毒性。临床数据显示,IBI363的3级及以上不良反应发生率仅为12%,显著低于传统IL-2(约30%),安全性与PD-1单药相当。目前,IBI363已启动针对后线NSCLC的II期注册临床,有望成为全球首个获批的PD-1/IL-2双抗。
2
ADC:差异化设计领跑全球,突破耐药人群治疗瓶颈
ADC(抗体-药物偶联物)是当前肿瘤药领域的研发热点,但国际竞品在靶点选择、毒素优化等方面逐渐趋同。国产ADC通过“新靶点+新毒素+新连接子”的差异化设计,在HER2、TROP2、EGFR/HER3等靶点上实现了对国际竞品的超越,尤其在耐药人群中展现出“颠覆性疗效”。
(1)科伦博泰sac-TMT:TROP2 ADC的“EGFR耐药人群双重获益”
TROP2 ADC是肺癌、乳腺癌领域的热门靶点,但国际竞品(如戈沙妥珠单抗)在EGFRm NSCLC后线人群中的疗效有限(mPFS约5.2个月)。科伦博泰的sac-TMT(TROP2 ADC)通过毒素与连接子的优化,在EGFR耐药人群中实现了“PFS与OS双重突破”。在III期临床中,针对3L EGFRm NSCLC人群(接受过EGFR-TKI及化疗),sac-TMT单药mPFS达到13.4个月,mOS达19.8个月,较SOC(化疗)的mPFS(4.3个月)和mOS(9.2个月)提升超过2倍,是全球首个在EGFR耐药后实现OS显著延长的TROP2 ADC。
其差异化优势体现在两方面:一是毒素选择——采用新型拓扑异构酶I抑制剂,旁观者效应更强(可杀伤邻近未表达TROP2的肿瘤细胞),且脱靶毒性更低(IC50值仅为戈沙妥珠单抗毒素的1/10);二是连接子设计——采用可裂解连接子,在肿瘤微环境中快速释放毒素,同时降低循环系统中的毒素暴露。在2L HR+/HER2-BC人群中,sac-TMT的mPFS达11.1个月,远超戈沙妥珠单抗的4.4个月,进一步巩固了其BIC地位。目前,科伦博泰已与默沙东达成sac-TMT的海外授权合作(交易额超10亿美元),计划在2026年申报FDA上市。
(2)百利天恒iza-bren:EGFR/HER3 ADC的“耐药突变全覆盖”
EGFR-TKI耐药是NSCLC治疗的核心难题,尤其是C797S、Exon20ins等罕见突变缺乏有效疗法。百利天恒的iza-bren(EGFR/HER3 ADC)通过双靶点设计,实现了对EGFR耐药突变的“全覆盖”。在I/II期临床中,针对EGFRm NSCLC后线人群(包括C797S、Exon20ins突变),iza-bren单药客观缓解率(ORR)达到100%,mPFS超12个月——这是全球首个在EGFR耐药人群中实现“全人群缓解”的ADC。
其靶点设计的巧妙之处在于:EGFR覆盖野生型、敏感突变及耐药突变(C797S、T790M等),HER3覆盖过表达人群,两者协同抑制EGFR通路的逃逸机制;同时,毒素采用新型微管抑制剂,可穿透血脑屏障,在脑转移人群中也观察到显著疗效(ORR 64%)。此外,iza-bren联合奥希替尼一线治疗EGFRm NSCLC的ORR达到100%,mPFS尚未成熟,有望成为一线治疗的FIC方案。
3
自免领域:靶点创新打破垄断,实现“疗效+安全性”双升级
自身免疫性疾病(自免)的治疗长期依赖TNF-α、IL-17等单抗,但存在响应率低、长期毒性等问题。国产新药在URAT1、TYK2、IL-17A/F等靶点上,通过机制创新与药物修饰,实现了疗效突破与安全性提升,部分品种已展现出FIC/BIC潜力。
(1)一品红氘泊替诺雷:URAT1抑制剂的“痛风石溶解”突破
痛风治疗的核心是降低血尿酸(sUA),但现有URAT1抑制剂(如非布司他)仅能降低sUA,难以溶解已形成的痛风石。一品红的氘泊替诺雷(氘代URAT1抑制剂)在II期临床中,单药或联合别嘌醇可使sUA降至360μmol/L以下(痛风治疗的目标值),且痛风石完全溶解率超过60%——这是全球首个明确具有痛风石溶解作用的URAT1抑制剂。
氘代修饰是其核心优势:通过将药物分子中的氢原子替换为氘原子,延长了药物半衰期(t1/2达24小时),减少了给药频率(每日1次),同时降低了肾脏毒性(同类药物常见的肾小管损伤风险)。临床数据显示,氘泊替诺雷的3级及以上不良反应发生率仅为3%,显著低于非布司他(约8%)。目前,氘泊替诺雷已启动III期注册临床,有望成为慢性痛风石的BIC疗法。
(2)丽珠集团LZM012:IL-17A/F双抗的“银屑病疗效升级”
IL-17A是银屑病的核心靶点,但部分患者对IL-17A单抗(如司库奇尤单抗)响应不佳,原因在于IL-17F在银屑病皮损中高表达,且与IL-17A具有协同作用。丽珠集团的LZM012(IL-17A/F双抗)在III期头对头试验中,针对中重度斑块状银屑病,12周PASI 100应答率(皮损完全清除)达到49.5%,显著优于司库奇尤单抗的40.2%——这是全球首个在头对头试验中超越IL-17A单抗的双抗。
LZM012的优势在于双靶点协同抑制:同时阻断IL-17A和IL-17F与受体的结合,更全面地阻断炎症通路。临床数据显示,LZM012的12周PASI 90应答率(皮损清除90%以上)达到89.3%,远超司库奇尤单抗的78.5%;且在脓疱型银屑病等难治性亚型中,ORR达到92%,展现出更广泛的适应症覆盖潜力。目前,LZM012已提交NDA申请,有望成为全球第二个获批的IL-17A/F双抗。
4
国产FIC/BIC新药突围的核心逻辑与挑战
(1)核心突围逻辑:以“临床价值”为导向的差异化创新
国产FIC/BIC品种的集体爆发,是行业从“政策驱动”向“价值驱动”转型的必然结果,核心逻辑聚焦三点:一是靶点选择直击临床未满足需求,精准锁定国际竞品未覆盖的痛点(如PD-L1低表达人群、EGFR耐药突变、痛风石溶解),避开同质化竞争;二是机制设计实现协同增效,通过双靶点融合(如PD-1+VEGF)、通路协同阻断(如IL-17A/F双抗),突破单靶点药物瓶颈,同时降低毒性;三是技术平台赋能产品升级,双抗研发平台、ADC毒素/连接子优化技术、氘代修饰等核心技术,为差异化设计提供硬支撑。
政策与产业生态的完善是重要保障:NMPA“优先审评、附条件批准”加速上市进程,国内全球多中心临床能力、CXO行业成熟度提升,降低了研发成本与风险,让企业得以聚焦源头创新。
(2)面临的核心挑战:从“临床数据”到“全球市场”的跨越
国产新药要实现“全球受益”,仍需突破三大关键挑战:一是全球多中心临床验证,现有数据多以中国人群为主,需在欧美人群中验证疗效与安全性,应对入组速度、种族差异、监管要求等多重考验;二是商业化能力短板,国际药企拥有成熟的全球销售网络与学术推广体系,国产药企需通过海外授权合作或本地化团队建设切入市场,同时应对医保谈判、定价策略等难题;三是知识产权与竞争风险,需在全球布局核心专利,规避侵权风险,同时抵御国际竞品快速跟进,维持技术领先性。
此外,创新药研发的高风险性不可忽视,早期临床品种后续数据存在不确定性,且热门靶点竞争加剧,需持续挖掘新靶点、新机制以保持长期竞争力。
5
结语:国产创新药的“全球新”时代已至
2025年的临床数据清晰地表明,国产创新药已不再只是“me-too”的跟随者,而是在多个领域实现了“全球首创”或“全球最优”。从PD-(L)1双抗的全人群获益,到ADC的耐药人群突破,再到自免靶点的疗效升级,这些品种不仅解决了临床未满足需求,更展现出与国际竞品同台竞争的实力。
未来,随着全球多中心临床的推进、海外授权合作的深化,国产创新药的“FIC/BIC”之路将逐步从“临床数据”走向“临床价值”——不仅能惠及国内患者,更有望在全球市场占据一席之地,真正实现“中国创新,全球受益”。

 研发追踪
研发追踪
 医药笔记
医药笔记  2026-02-05
2026-02-05
 51
51

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-04
2026-02-04
 92
92

 研发追踪
研发追踪
 药研网
药研网  2026-02-04
2026-02-04
 103
103