 研发追踪
研发追踪
 细胞基因治疗前沿
细胞基因治疗前沿  2025-11-24
2025-11-24
 699
699
2025年11月18日,Arrowhead Pharmaceuticals宣布FDA已批准其siRNA药物REDEMPLO(plozasiran)上市,作为饮食疗法的辅助手段,用于降低家族性乳糜微粒血症 (FCS) 成人患者的甘油三酯水平。根据新闻稿 ,REDEMPLO是首款也是目前唯一一款获得 FDA 批准用于治疗FCS的siRNA药物,患者可在家中自行给药,只需每三个月进行一次简单的皮下注射即可。
REDEMPLO将于今年年底前在美国上市,定价为6万美元/年,并承诺采用“适用于当前和未来适应症的统一价格”定价模式。

REDEMPLO是一款靶向APOC3基因的“first-in-class”RNAi疗法,基于Arrowhead专有且具差异化的Targeted RNAi
Molecule(TRiM)平台所开发。通过持续沉默APOC3基因,REDEMPLO可显著降低甘油三酯水平。这是Arrowhead首个获得 FDA
批准的药物,标志着该公司向商业化阶段过渡的一个重要里程碑。
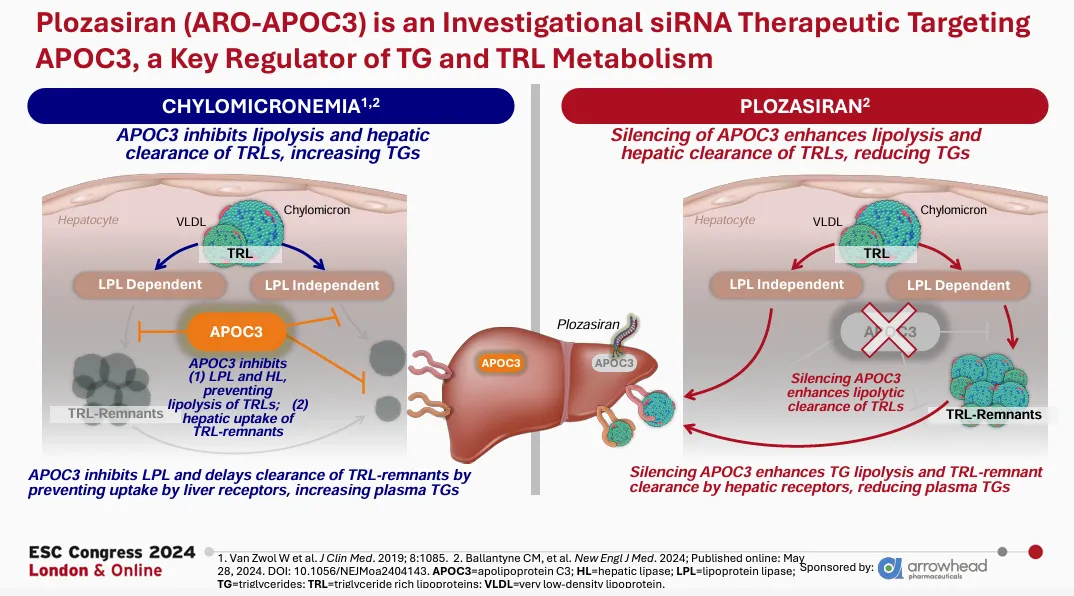
REDEMPLO获得了美国FDA授予的突破性疗法认定、快速通道认定和孤儿药认定,用于治疗患有FCS的患者;同时,它也获得了欧洲药品管理局授予的孤儿药认定,用于治疗患有FCS的患者。
REDEMPLO包装和预灌封注射器
FCS 是一种严重的罕见疾病,据估计,美国约有6500人患有遗传性或临床型 FCS,其特征是甘油三酯水平可比正常水平高出10至100倍,从而显著增加发生急性、复发性甚至致命性胰腺炎的风险。
FDA的批准基于PALISADE III期临床研究的数据。PALISADE是一项随机、双盲、安慰剂对照试验,受试者为临床诊断或遗传学确诊的家族性乳糜泻(FCS)成人患者。PALISADE研究达到了其主要终点和所有多重性控制的关键次要终点,包括显著降低甘油三酯和APOC3水平。在PALISADE研究中,25 mg REDEMPLO可显著且持久地降低甘油三酯水平,与安慰剂组相比,甘油三酯中位值较基线下降了80%,而安慰剂组仅为17%。此外,与安慰剂组相比,25 mg REDEMPLO组的急性胰腺炎发生率也更低。
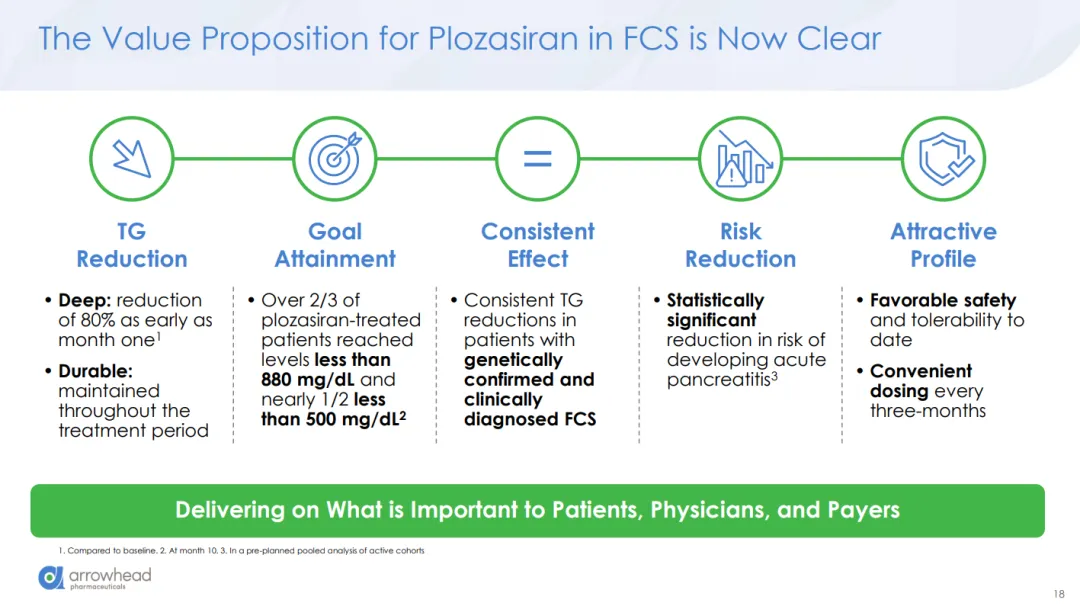
REDEMPLO治疗患者中最常见的不良反应(发生率≥10%,且比安慰剂组高5%以上)包括高血糖、头痛、恶心和注射部位反应。
“REDEMPLO获得FDA批准是Arrowhead公司发展历程中的一个里程碑。对于所有参与研发过程的人员来说,这都是一个值得骄傲的时刻,也为美国约6500名患有遗传性或临床型FCS的患者带来了新的希望。此次获批及随后的上市标志着我们征程新篇章的开启——我们始终致力于为罹患重疾的患者提供改变生命的疗法,”Arrowhead Pharmaceuticals总裁兼首席执行官Christopher Anzalone博士表示。“REDEMPLO也是首个获得FDA批准的、采用Arrowhead专有的、差异化的靶向RNAi分子(TRiM™)平台的药物。Arrowhead在创新领域持续引领潮流,TRiM™平台目前有望将siRNA递送至体内七种不同的细胞类型,并有可能在一个分子中同时抑制两个基因的表达。这项技术的广度以及我们不断增强的商业能力,将极大地拓展我们能够治疗的疾病种类,并改变更多患者的生命。”
公司管线
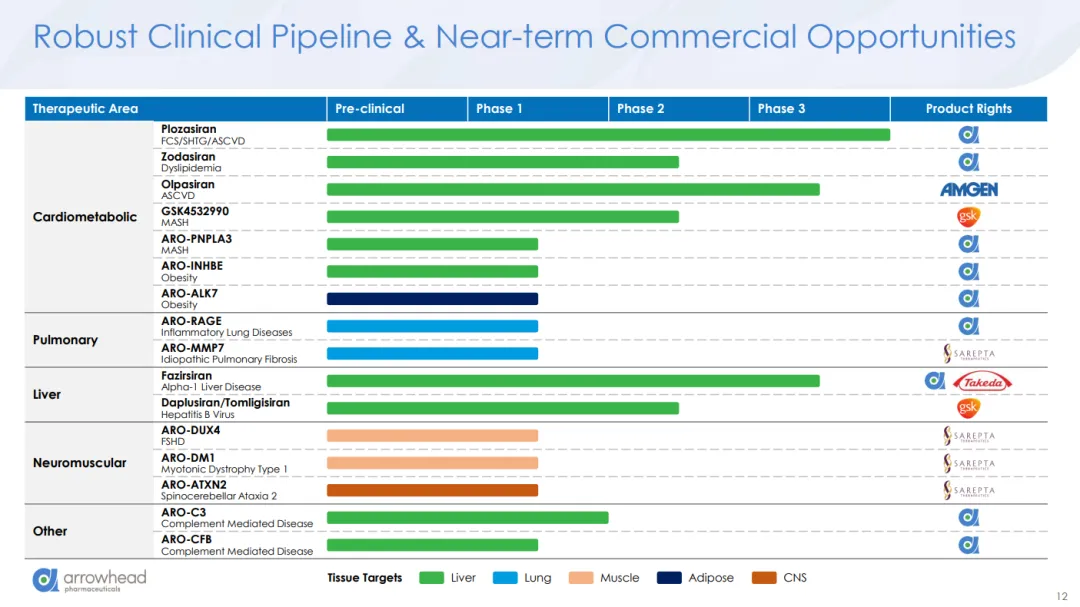
过去一年,对Arrowhead来说可谓动作频频。去年11月,该公司以8.25亿美元的首付款将多个临床和临床前siRNA项目授权给Sarepta,此外,根据患者招募情况和其他临床开发里程碑,还将分期支付高达100亿美元的款项。今年7月,Sarepta宣布进行战略重组,调整产品线,从传统的基因疗法转向这些新项目。随后,Sarepta的基因疗法Elevidys的安全问题爆发,Arrowhead的股价在一个月左右的时间里下跌了12%。
今年8月,赛诺菲与Arrowhead的子公司维亚臻签署资产购买协议,获得REDEMPLO在大中华区的开发与商业化权利。根据协议,维亚臻将获得1.3亿美元预付款,并有资格在REDEMPLO于中国大陆获批不同适应症后获得最高2.65亿美元的里程碑付款。今年9月,Arrowhead宣布与诺华就临床前资产siRNA-ARO-SNCA达成全球授权合作。诺华将向Arrowhead支付2亿美元预付款,以及最高20亿美元的里程碑付款及销售分成。
未来,Arrowhead公司将面临激烈的市场竞争。去年,FDA批准了首个治疗该疾病的药物,即Ionis Pharmaceuticals公司的Tryngolza。该药上市时的年定价为59.5万美元,在2025年前九个月的销售额达到了5700万美元。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 19
19

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 17
17

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 17
17