 研发追踪
研发追踪
 佰傲谷BioValley
佰傲谷BioValley  2025-11-25
2025-11-25
 623
623
日前,PeproMene Bio表示,其关于BAFFR CAR-T候选药物PMB-CT01的1期临床研究成果已入选2025年美国血液学会(ASH 2025)年会摘要,将在ASH 2025年会上进行口头报告。
BAFFR CAR-T在复发和难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)延续此前报告的100% CR,且至今无复发;在复发和难治性急性B淋巴细胞白血病(r/r B-ALL)展示了良好的初始安全性和有效性,获得缓解的患者持续缓解,截至数据截止无复发。
BAFFR CAR-T
BAFFR CAR-T由希望之城(City of Hope)首创。
BAFFR是肿瘤坏死因子(TNF)受体超家族成员。BAFFR作为BAFF的主要受体,几乎仅在B细胞上表达,并特异性参与B淋巴细胞分化和B细胞存活。尤其是BAFFR在恶性B细胞上的广泛表达使其成为一个高价值的潜在肿瘤靶标。Larry W. Kwak博士的实验室发现了新型人源化抗BAFFR单克隆抗体,对各种B细胞肿瘤细胞均具有高结合亲和力和细胞毒活性。
同时,由于BAFFR信号转导促进正常的B细胞增殖和B细胞存活,因此肿瘤细胞不太可能丢失BAFFR抗原,从而逃避治疗(通常CD19 CAR-T治疗会因为CD19抗原丢失而导致肿瘤复发),这一特点也使得BAFF-R成为B细胞肿瘤CAR-T的下一代新星靶标,以及作为CD19 CAR-T治疗失败的潜在靶点选择。
PMB-CT01是一款 first-in-class 的BAFFR靶向自体CAR-T细胞疗法。由希望之城综合癌症中心副总裁兼副主任、PeproMene科学创始人Larry W. Kwak博士的实验室发明。PeproMene于2017年从希望之城获得了与PMB-CT01相关的知识产权许可。
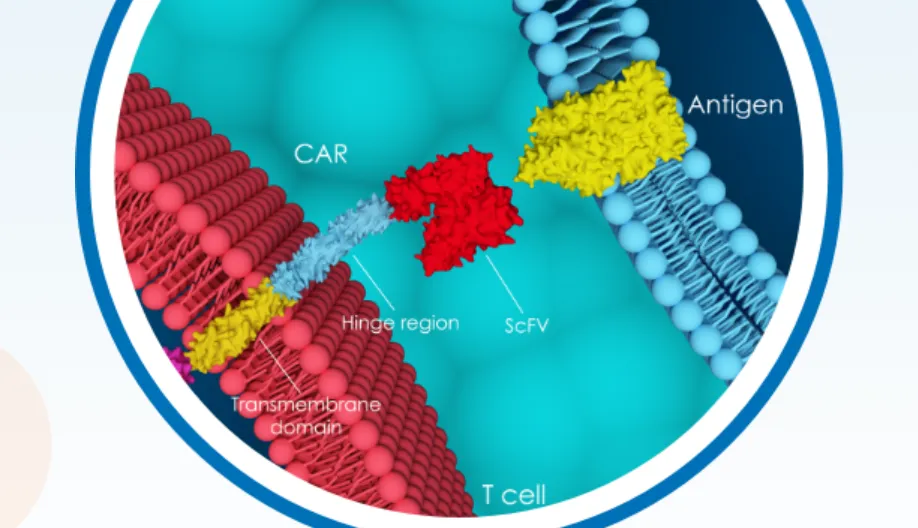
图片来源:参考资料2
PMB-CT01的CAR包含了抗BAFFR的单链可变区抗体与包含CD3ζ和4-1BB的第2代信号转导结构域。研究发现,BAFFR CAR-T细胞在体外能够杀死人类淋巴瘤和白血病细胞,并在体内杀死已确诊的淋巴瘤和白血病细胞。
目前,PMB-CT01处于1期临床阶段,正在进行两项1期临床研究,分别针对复发和难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)(PMB-102;NCT05370430)、复发和难治性急性B淋巴细胞白血病(r/r B-ALL)(PMB-101;NCT04690595)。
B-NHL:100% CR,至今无复发
根据发布的ASH 2025摘要。
在BAFFR CAR-T候选药物PMB-CT01治疗r/r B-NHL的1期研究PMB-102中,共有7名患者接受了PMB-CT01治疗。诊断包括弥漫性大B细胞淋巴瘤(MCL,n=4)、CD19-和CD20-阴性T细胞/组织细胞丰富的大B细胞淋巴瘤(THRLBCL,n=1)、边缘区淋巴瘤(MAL,n=1)和滤泡性淋巴瘤(FL,n=1)。患者年龄中位数为62岁(范围41-75),其中6名为男性患者。患者此前接受过1-10线治疗,包括CD19 CAR-T治疗(n=4)和一种CD3/CD20双抗治疗。3名患者接受DL1治疗(剂量为50×106 CAR-T cells),4名患者接受DL2治疗(剂量为200×106 CAR-T cells)。
安全性方面:PMB-CT01表现出良好的耐受性特征,未发生剂量限制性毒性(DLT),所有患者中仅出现1级CRS和1级免疫效应细胞相关神经毒性综合征(ICANS),未发生任何程度≥2级的CRS和ICANS。
疗效:前7例患者患者在输注后1-3个月内达到完全缓解(100% CR),包括之前接受过CD19 CAR-T治疗的患者和CD19阴性的患者。患者反应持久,无复发情况,且缓解持续时间最长达32个月(中位持续缓解时间17个月,范围3-32个月)。在MCL患者中,3名接受检测的患者在治疗后的1个月和≥6个月时检测为微小残留病(MRD)阴性。所有接受检测的患者均观察到显著的CAR-T细胞扩增现象。
PeproMene公司表示,鉴于目前观察到的良好安全性和持久缓解,预计200×106 CAR T cells将会是未来研究的推荐剂量。一旦确定推荐的2期剂量,将同时开启3个组织学扩增队列,包括FL、MCL和LBCL。另外,该公司预计将于ASH 2025年会上公布试验已完成的9名患者递增部分研究结果。
B-ALL:CR 67%,安全性良好
根据发布的ASH 2025摘要。
在BAFFR CAR-T候选药物PMB-CT01针对r/r B-ALL患者的一项1期研究中,这些患者不符合CD19靶向治疗的条件或之前使用过CD19靶向治疗但未见效。目前入组工作仍在进行中,已有6名患者完成登记。患者的中位年龄为36岁(31-59),其中4名为男性患者。患者前期治疗线数中位数为5(2-5);所有患者均接受过布林妥莫单抗治疗,其中4名接受过CD19 CAR-T治疗,且4名患者为CD19阴性。
安全性方面:截至目前,尚未观察到剂量限制性毒性(DLT)。耐受性良好,没有出现≥3级的CRS,有4名患者经历了CRS,仅有1例2级其余为1级;仅发生了1例1级ICANS,该症状在未进行干预的情况下已得到缓解。
疗效:6名患者中有4名实现了未检测到的最小残留疾病(MRD)的完全缓解(CR:66.67%);4名缓解患者中,有3名在纳入研究时呈CD19阴性,这3名患者目前已成功转化为异基因造血干细胞移植(HCT)。
在数据截止时(中位随访时间为180天,范围:39-655),所有4名缓解患者仍处于缓解状态。在所有6名患者中均观察到显著的CAR-T扩增现象,其峰值水平出现在输注后第11天至21天。截至当前数据收集时,CAR-T细胞已持续存在长达6个月。
结果显示,BAFFR CAR-T显示出良好的初始安全性。BAFFR CAR-T在先前接受过CD19靶向治疗且治疗方案有限的r/r B-ALL患者中显示出良好的活性。值得注意的是,BAFFR CAR-T成功的将患者过渡到有可能实现根治性治愈的造血干细胞移植阶段。
小结
CD19 CAR-T治疗的肿瘤复发,一直是研究的重点领域,推出了多种治疗策略,包括CD19/CD20的双靶点、不同靶点的CAR-T的序贯治疗等。
但是根据PeproMene公司报告的数据来看,其接受BAFFR CAR-T治疗并获得缓解的患者至今仍然处于缓解状态,未见肿瘤复发。——其潜在前景积极。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 19
19

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 17
17

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 17
17