 产业资讯
产业资讯
 丁香园
丁香园  2025-11-27
2025-11-27
 38
38
一针近 1500 万的药,曾因相关研究论文撤稿争议缠身。
最近,这款药再度获批新的适用人群。
此药是 Zolgensma,诺华旗下的 AAV 基因治疗药物,每针售价 210 万美元(约合人民币 1492 万元),2019 年首次上市时,曾刷新全球最贵药榜单。
当地时间 11 月 24 日,诺华宣布,FDA 批准该药用于治疗 2 岁及以上儿童、青少年和成人脊髓性肌萎缩症(SMA)患者,这些患者需具有经确认的 SMN1 基因突变(5q SMA)。
至此,这款药物成为全球首个、也是唯一一个可用于这一广泛人群的基因替代疗法。[1]
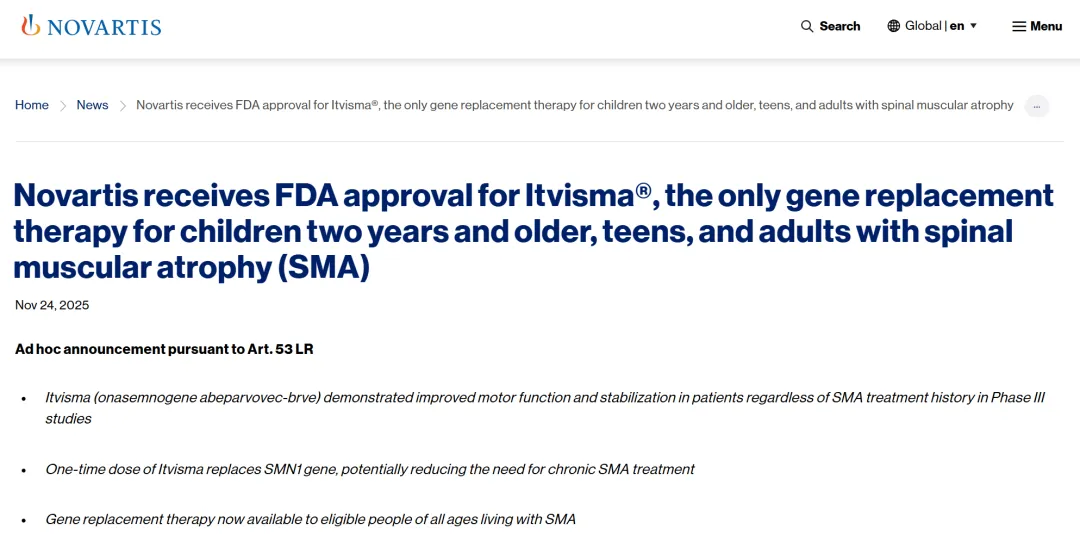
图源:参考资料 1
90% 患儿活不过 2 岁,全新基因疗法一生只需一针
脊髓性肌萎缩症(SMA),中国《第一批罕见病目录》病种,虽然总体发病率不高,但却是婴幼儿常见的致死致残性神经肌肉疾病。[2,3]
它是一种常染色体隐性遗传神经肌肉疾病,因 SMN1 基因缺失或变异引起。
SMN1 基因编码人体肌肉的大部分 SMN 蛋白,涉及包括呼吸、吞咽和基本运动在内的重要运动。当 SMN1 基因突变或缺失,运动神经元会发生不可逆损失,出现近端肢体和躯干进行性、对称性肌无力和肌萎缩的神经变性。
最终临床表现为进行性肌无力和肌萎缩,通常还合并呼吸、消化及骨骼等多系统损害。[3]
据统计,SMA 全球发病率在活产儿中约为(7.8~10)/10 万例。90% 患有 SMA 的婴儿,活不过 2 岁。[4]
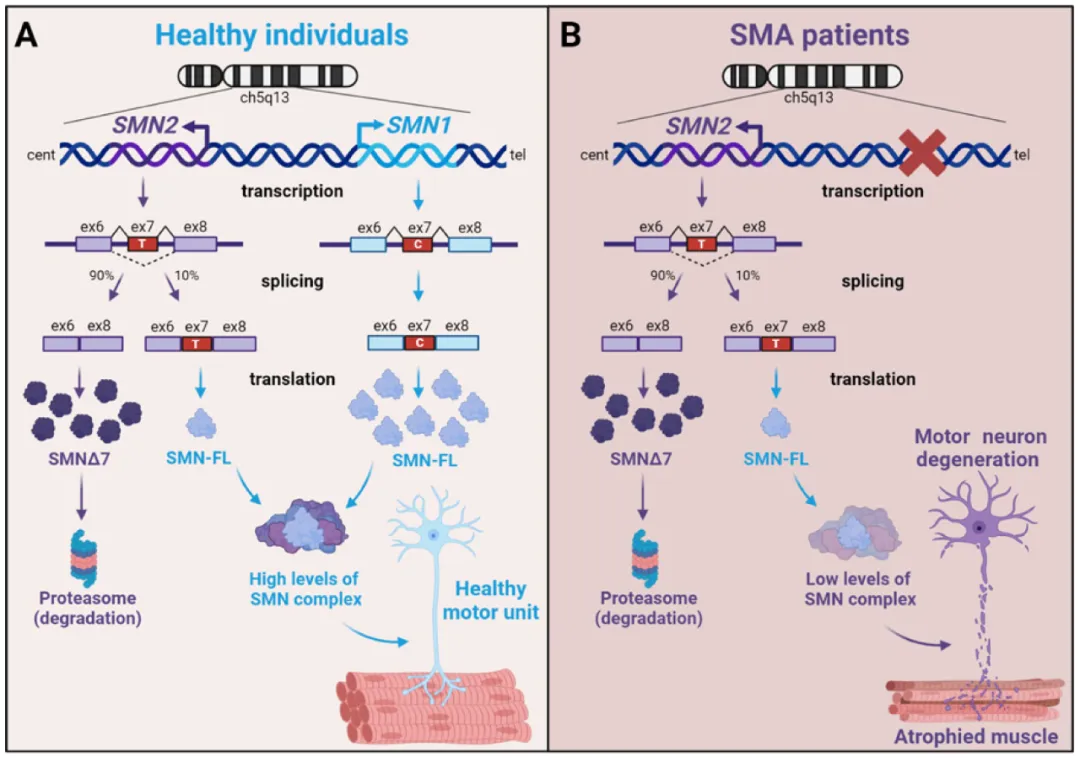
SMA 发病机制,图源:参考资料 5
自 19 世纪末被首次发现以来,SMA 在很长一段时间内只能进行姑息治疗、症状管理。
直到 2016 年,全球首个治疗 SMA 的疾病修正治疗(disease modifying therapy,DMT)药物上市,给 SMA 治疗带来了革命性突破。
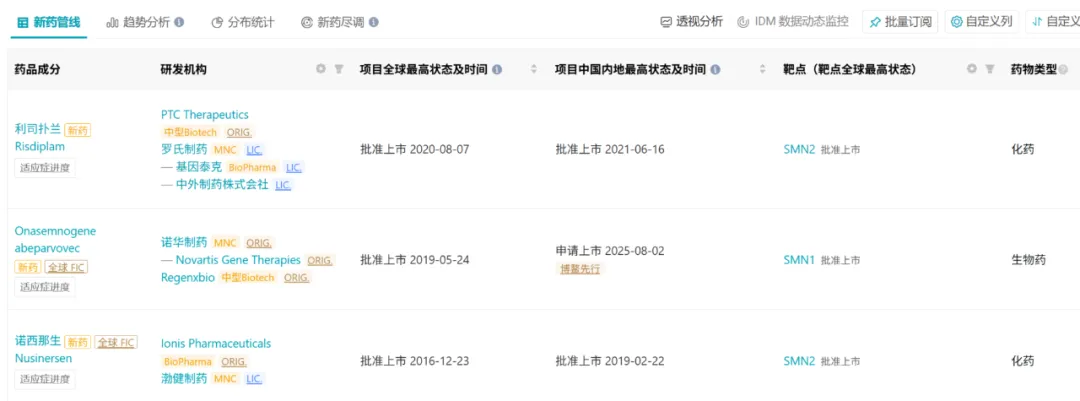
目前全球范围范围内,SMA 新药仅获批 3 款,包括 2 款化药和 1 款基因治疗药物,图源:丁香园 Insight 数据库
本次再度获批的 Zolgensma,是诺华在 2018 年收购自 AveXis 公司的研发管线,收购次年就首次获得 FDA 批准上市,用于治疗两岁以下 SMA 患者。[6]
Zolgensma 通过替换 SMN1 基因,可以有效改善 SMA 患者的运动功能。
而且理论上,它只需进行一次性固定剂量的治疗,就能移除 SMA 的根本遗传病因,无需根据年龄或体重调整剂量,对比其他疗法,优势十分简单粗暴。
本次再获批准、成功将适用人群拓展到了两岁及以上的全部患者人群,主要是基于全球 III 期临床 STEER 研究和开放标签 IIIb 期 STRENGTH 研究。[7]
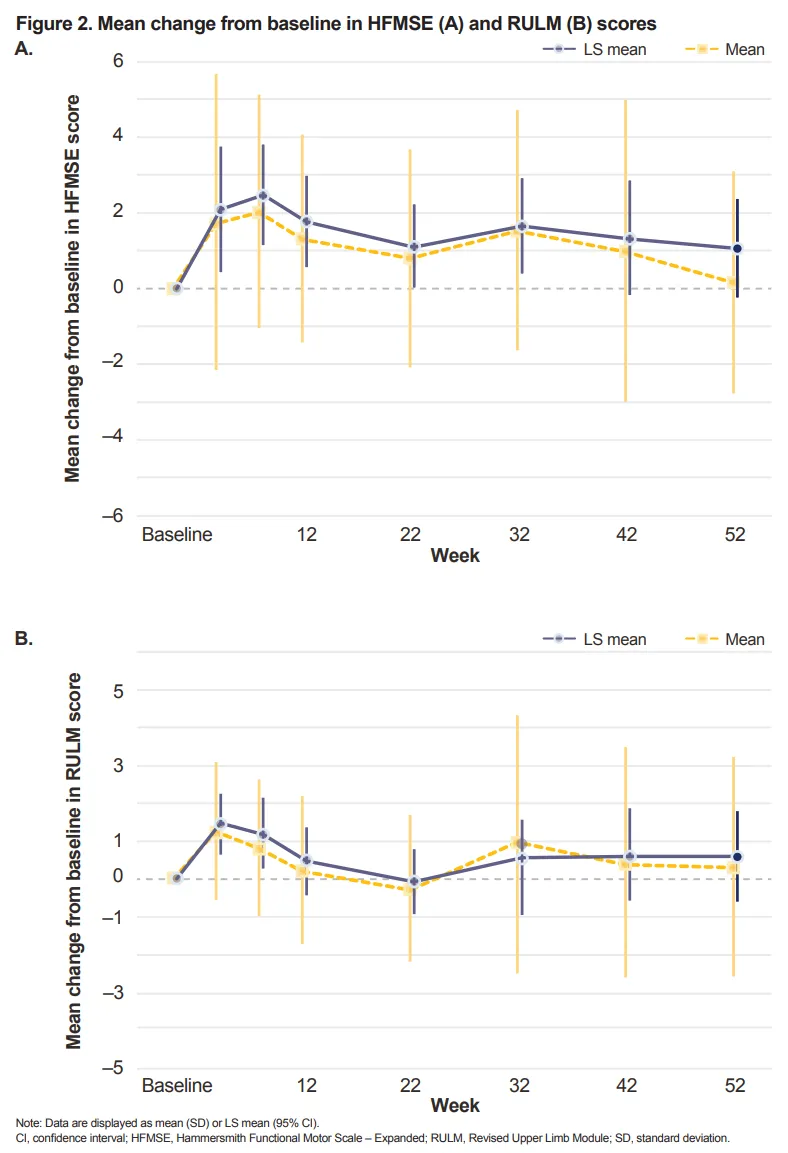
图源:参考资料 7
研究结果显示,接受 Zolgensma 治疗的患者,在运动功能方面有了显著的改善,实现了「在疾病自然病程中通常难以观察的运动能力」。
而且,这样的疗效在 52 周随访中一直维持。
同时,Zolgensma 安全性良好,最常见的不良事件主要为上呼吸道感染、发热和呕吐。[7]
一针近 1500 万,此前曾陷撤稿风波
不过,比起一生只需一针的巨大优势,Zolgensma 另一个备受瞩目的特点,就是贵——
每针定价 210 万美元(约合人民币 1495 万元),位列最新版「全球十大最贵药物」第 9。
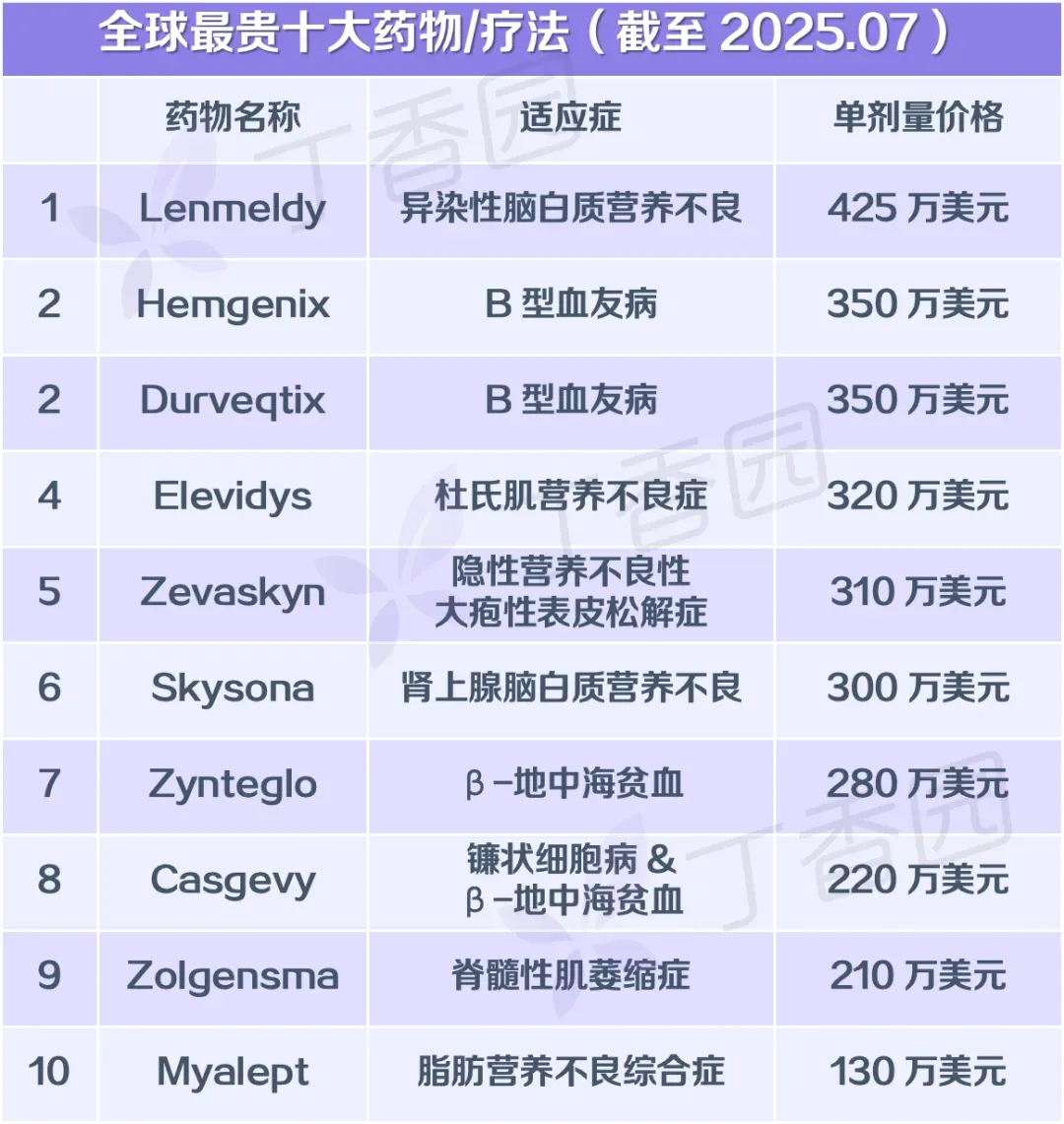
图源:丁香园整理自公开资料
这样的天价药,上市后最大的「坎」,通常都是商业化困难,卖不出去无奈撤市的比比皆是。
Zolgensma 算是例外。根据公司财报,Zolgensma 上市后第一季度销售额就达到了 1.6 亿美元,2021 年销售额高达 13.51 亿美元,2022 年销售额进一步上涨到 13.7 亿美元,2024 年销售额为 12.14 亿美元。
它最大的争议,来自一次重要研究的撤稿。
2022 年 10 月 6 日,Nature Biotechnology(IF=68)以「数据不准确」为由,撤回了 2010 年发表的 Zolgensma 相关研究。[8]

图源:参考资料 8
2021 年,文章的作者提醒期刊注意文中图 1e 处存在不准确之处。后来,文章作者提供了源数据文件,证实其报告的小鼠寿命、将动物纳入或排除出具体分析的流程存在多处出入。
其中,原文章中报告 6 只接受基因治疗的小鼠存活了 250 多天,但实际仅有 1 只。
因此,杂志编辑与审稿人员判断该文章的数据已经不再充分可信,决定撤稿。[8]
不过,这次撤稿虽然引发了不少关注,但很快就被发现并不影响 Zolgensma 的获批。
SMA 诊疗专家、浙江大学附属儿童医院神经内科主任医师毛姗姗教授就指出,文章内容主要涉及为临床前研究,受影响的主要是试验模型动物的疗效数据,并未推翻 Zolgensma 的作用机制。

而 Zolgensma 的临床试验数据一直较积极,也因此,虽然撤稿,但诺华公司及其产品并未受到更严重的影响或处罚。
这场风波最终的后果,仅仅是撤回了这一篇论文。如今成功获批拓展适应症人群,再次为 Zolgensma 验明了正身。
然而,临床应用,看的并不只是疗效。
诚然,如前文所提,Zolgensma 上市后的销售额并不低,但高昂的定价依然让许多患者望而却步。「至少我接触到的患者,几乎没有人真的选择使用。」
「如今拓展了适应人群,大批库存患者有机会体验『一生只打一针』,还是很有吸引力的。」毛姗姗表示,「只不过,如果没有大幅降价或高比例的保险报销,光有吸引力是很难真正发挥临床作用的。」
目前,Zolgensma 已在我国申报上市,用于治疗 6 月龄及以上 5q 型 SMA 患者,最新消息显示,这一适应症已被纳入优先审评。

 产业资讯
产业资讯
 药时空
药时空  2025-11-27
2025-11-27
 42
42

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-27
2025-11-27
 41
41

 产业资讯
产业资讯
 丁香园
丁香园  2025-11-27
2025-11-27
 38
38