 研发追踪
研发追踪
 药时空
药时空  2025-12-01
2025-12-01
 1034
1034
2025年11月24日,Kelonia官宣,其研发的KLN-1010 管线1期首批临床结果,将以口头报告形式在2025年美国血液学会(ASH)年会上公布。作为一款体内CAR-T 疗法,KLN-1010无需单采制备流程,可在人体内部直接生成抗 B 细胞成熟抗原(BCMA)的CAR-T细胞,专门用于治疗复发和难治性多发性骨髓瘤(RRMM)。该临床试验名为inMMyCAR(试验编号NCT07075185),于2025 年8月19日完成首例患者给药,仅时隔三个多月便迎来首批临床结果的正式披露。
此次ASH口头报告的题目为Minimal residual disease (MRD)-negative outcomes following a novel, in vivo gene therapy generating anti–B-cell maturation antigen (BCMA) chimeric antigen receptor (CAR)-T cells in patients with relapsed and refractory multiple myeloma (RRMM): Preliminary results from inMMyCAR, the first-in-human Phase 1 study of KLN - 1010,其披露的摘要聚焦首批3名受试患者的疗效和安全性,整体表现亮眼。治疗后1个月,所有患者均达到微小残留病灶(MRD)阴性标准,检测灵敏度达 10⁻⁵或 10⁻⁶;其中随访时间最长的首例患者,该MRD阴性状态(10⁻⁶灵敏度)持续至治疗后3个月。依据IMWG评估标准,3名患者治疗1个月时均实现部分缓解,且截至结果披露时均维持缓解状态,无复发情况出现。
KLN-1010 1期临床试验核心细节
该1期临床试验对入组患者设定了明确标准:需确诊为具有可测量病灶的RRMM,具备良好的器官及骨髓功能;且既往接受过至少3线治疗,治疗方案需包含一种蛋白酶体抑制剂(PI)、一种免疫调节药物(IMID)以及一种抗CD38单克隆抗体。试验采用3+3剂量爬坡设计,剂量递增方式为半对数递增。
首批入组的3名患者年龄介于61-72岁,患病时长7.9-9.4年,均携带高危细胞遗传学特征,且有3-4线既往治疗史。其中2名患者对PI、IMID及抗CD38疗法均存在耐药性;值得注意的是,所有患者此前均未接受过BCMA靶向治疗,且无髓外受累情况。
安全性表现
3名患者在治疗过程中均出现了治疗相关不良事件,这类不良事件主要集中在药物输注阶段和CAR-T细胞扩增阶段。输注相关反应方面,2名患者在输注后30-60分钟内出现症状,且均在6-48小时内缓解;鉴于首例患者出现该反应,后续2名患者均预防性使用托珠单抗,有效保障了治疗安全。
在CAR-T细胞扩增期间,2名患者出现2级细胞因子释放综合征(CRS),但未观察到免疫效应细胞相关神经毒性综合征,也无帕金森病、颅神经麻痹等迟发性神经毒性反应。血液学毒性方面,仅1名患者在治疗第15天出现持续1天的3级贫血,另1名患者在第1天和第15天出现3-4级中性粒细胞减少;整个治疗首月,无患者出现≥3级血小板减少、≥3级血液毒性及治疗引发的感染,安全性整体可控。
CAR- T细胞动力学特征
该疗法的一大突破在于无需进行预处理化疗,仍实现了CAR-T细胞的高效扩增。3名患者的绝对淋巴细胞计数(ALC)峰值出现在治疗第13-18天,数值分别为 2.3×10⁹/L、7.37×10⁹/L 和 43.1×10⁹/L。治疗第15天检测显示,CAR阳性细胞占 CD3+淋巴细胞的比例分别为35%、22%和72%,其中两个样本的基因组DNA载体转导拷贝数更是达到51647拷贝/μg 和 65873拷贝/μg。
对于ALC数值最高的患者,其出现的淋巴细胞增多症经地塞米松治疗后迅速缓解,且未产生明显临床不良后果。治疗3个月后,研究人员仍能从患者的骨髓和外周血中检测到CAR-T细胞,且这些细胞以记忆表型为主,为长期维持治疗效果提供了潜在支撑。
KLN-1010与ESO-T01的多维度对比
KLN-1010与ESO-T01是目前公开数据中仅有的两款采用慢病毒载体技术的体内 CAR-T产品,均用于RRMM治疗。其中ESO-T01由EsoBiotec公司研发,该公司于 2025年3月被阿斯利康以最高10亿美元总价收购,成为巨头布局体内CAR-T赛道的核心抓手,其相关临床数据已发表于《柳叶刀》期刊。需特别提示,两款疗法目前公开的临床数据均基于小样本试验,解读时需保持审慎。
体内CAR-T疗法凭借 “无需单采、体内直接生成CAR-T细胞” 的特性,已成为多发性骨髓瘤治疗领域的研发焦点。当前该领域形成慢病毒载体与RNA递送两大技术路线,其中慢病毒载体可将CAR基因永久整合至宿主 T 细胞基因组,实现CAR蛋白的持久表达,是临床转化的重要方向,这也为两款疗法的对比提供了核心技术背景。以下从多维度展开具体对比:
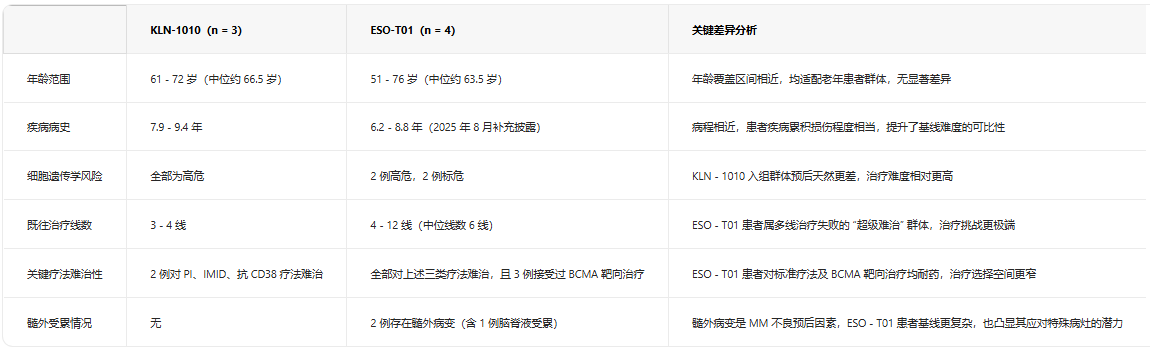
基线特征:治疗难度基准差异显著
两款疗法的入组患者虽均为RRMM群体,但疾病严重程度和治疗背景差异明显,直接影响疗效与安全性的对比参照标准,具体数据如下:
疗效表现:差异化优势适配不同患者
两款疗法均以MRD阴性率、缓解深度及持续时间为核心疗效指标,因患者基线差异呈现出互补性优势:
缓解深度
KLN-1010起效更均衡,ESO-T01擅解复杂病灶。KLN-1010实现100% MRD阴性率,起效一致性突出,适配无髓外病变的高危 RRMM患者;ESO-T01虽MRD阴性率为75%,但取得多项突破性疗效 ——4例患者均实现客观缓解,其中2例达严格意义完全缓解、1例达非常好的部分缓解,更关键的是其成功实现2例髓外病变(含脑脊液受累)患者病灶完全消退,而这类病灶正是传统CAR-T 疗法的治疗难点。此外,ESO-T01 对复发患者的二次给药也能实现缓解,验证了其在复发病例中的应用价值。
缓解持续性
短期稳定,长期数据待完善。KLN-1010 目前最长随访期3个月,3例患者均维持缓解;ESO-T01最长随访14个月,3例MRD阴性患者中2例维持缓解至14个月,1例复发后经二次给药恢复缓解。ESO-T01的二次给药有效为复发患者提供了新的治疗思路,而 KLN-1010的长期疗效则需更长周期的随访数据支撑。
安全性:均规避严重毒副反应,管理策略各有侧重
传统CAR-T疗法面临的严重CRS和神经毒性等痛点,在两款体内CAR-T疗法中均得到有效规避,具体安全性差异如下表所示:
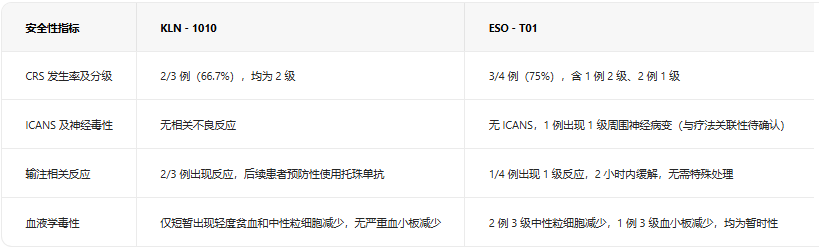
整体来看,两款疗法均无重度、持续性血液毒性,KLN-1010的预防用药方案为临床提供了可借鉴的安全管理经验,ESO-T01则以更低的输注相关反应发生率展现出良好的安全性基础。
CAR- T细胞动力学:扩增与存续性差异凸显技术特点
扩增效率
KLN-1010无预处理仍达高效扩增。KLN-1010在未进行预处理化疗的情况下,CAR 阳性细胞占CD3+淋巴细胞比例最高达72%;而ESO-T01部分患者需接受低剂量环磷酰胺预处理,其CAR 阳性细胞占比最高为45%。KLN-1010 的这一表现打破了 “预处理提升CAR-T扩增效率” 的传统认知,这得益于其慢病毒载体经工程化包膜设计后,对T细胞的靶向结合与转导效率大幅提升,为降低患者治疗负担提供了技术支撑。ESO-T01则实现了髓外病灶区域CAR-T细胞浸润,体现出独特的跨屏障迁移能力。
细胞存续性
均实现长期存续,表型特征各有侧重。KLN-1010 治疗3个月后仍可检测到CAR-T 细胞,且以记忆表型为主,该表型有助于长期维持治疗效果;ESO-T01治疗6个月后,3例患者外周血中可检测到CAR-T 细胞,且以效应记忆T细胞为主。两者的长期存续特性,均源于慢病毒载体介导的CAR基因基因组整合技术,为疗效持久性提供了保障。
总结与行业展望
KLN-1010 与ESO-T01作为慢病毒载体介导的体内CAR-T 疗法代表,凭借无需单采、安全性优、缓解效果显著等核心优势,为RRMM治疗带来了全新突破,且形成了差异化的临床定位:KLN-1010聚焦高危、未接受BCMA靶向治疗的RRMM患者,其100% MRD 阴性率和无预处理扩增的特点,使其具备成为BCMA靶向治疗一线选择的潜力,且其技术平台已获得强生、安斯泰来等巨头认可,商业化前景广阔;ESO-T01则专注于多线治疗失败、伴髓外病变等复杂难治性RRMM患者,为传统 CAR- T疗法束手无策的末线患者提供了新选择,阿斯利康收购后已启动Ⅱ期临床筹备,计划扩大髓外病变患者入组比例。
随着2025年ASH年会KLN-1010更多临床数据的披露,以ESO-T01Ⅱ期临床试验的推进,慢病毒载体介导的体内CAR-T疗法的载体优化方向、患者分层标准将进一步清晰。目前 KLN-1010 背后的强生、安斯泰来联盟,与ESO-T01所属的阿斯利康,已形成针对不同病情RRMM患者的差异化竞争格局。未来,慢病毒载体平台在疗效持久性上的优势将进一步凸显,与脂质纳米颗粒等非病毒载体形成 “长效 - 安全” 的互补生态,共同推动多发性骨髓瘤治疗领域的变革。
原链接:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 19
19

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 17
17

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 17
17