 研发追踪
研发追踪
 医药魔方Pro
医药魔方Pro  2025-12-03
2025-12-03
 813
813
“合成致死”被认为是一种极具前景且广受关注的抗癌治疗策略。先前研究表明,抑制在多种癌症中高表达的蛋白激酶膜相关酪氨酸/苏氨酸 1(PKMYT1)有望实现对携带特定基因突变的癌症细胞的精准杀伤。然而,当前在研PKMYT1抑制剂面临剂量限制性毒性、临床药效表现不足、肿瘤耐药突变等多重挑战。这些挑战使得探索更高效、更安全的PKMYT1靶向治疗策略,成为当前的研究热点。
11月28日,英矽智能团队在Nature Communications(IF=15.7)杂志发表最新突破成果。利用生成式化学平台Chemistry42,研究团队设计出了靶向PKMYT1、具有同类最佳潜力的新型PROTAC分子D16-M1P2。该分子采用双重作用机制——一方面可诱导PKMYT1降解,另一方面直接抑制其激酶活性。这种“双重”策略有望克服现有抑制剂选择性差、易耐药等缺陷,同时靶向PKMYT1的催化与非催化功能,展现出更持久、强效的疗效潜力。

PROTAC是一类新型双功能分子,通常由三个基本部分构成:能够结合目标蛋白 (POI) 的配体、募集 E3
泛素连接酶的配体、以及连接上述两者的连接子。PROTAC通过招募人体细胞内固有的蛋白质降解系统,实现对疾病发生发展关键蛋白的选择性、可控性降解。该机制有望突破小分子抑制剂“不可成药”靶点的开发瓶颈,并为应对临床上的获得性耐药等难题提供新思路。目前,全球进展最快的PROTAC项目已递交上市申请。
AI设计新型PKMYT1抑制剂
据论文介绍,目前进展最快的PKMYT1抑制剂RP-6306由于其结构特征,难以作为理想的PROTAC配体。针对这一挑战,英矽智能团队从已有的PKMYT1抑制剂和广谱激酶抑制剂出发,在Chemistry42平台输入药效团结构信息,并设定了分子新颖性和ADME等性质的筛选条件。团队利用Chemistry42整合的40余种生成模型在铰链区进行片段替换,并在溶剂暴露区进行定向片段生长。经过对新颖性、靶点亲和力、成药性等多维度的严格筛选,化合物1从AI生成的2023个候选分子中脱颖而出,其对PKMYT1表现出低微摩尔级的结合活性。
研究团队进一步发现,基于Chemistry42平台中Golden Cubes激酶活性预测工具结果,化合物1具有低于已有分子的脱靶风险,支持后续结构活性关系(SAR)分析优化。接着,基于结构的药物设计和进一步的合成及测试,团队对化合物1进行了多轮迭代优化,最终获得了生物活性和药代动力学性质更优的化合物4,不仅实现了低纳摩尔级别的结合活性、较好的溶解度和体内代谢稳定性,还具备优异的激酶选择性,同时拥有理想的连接位点,为后续PROTAC分子的开发奠定了坚实基础。
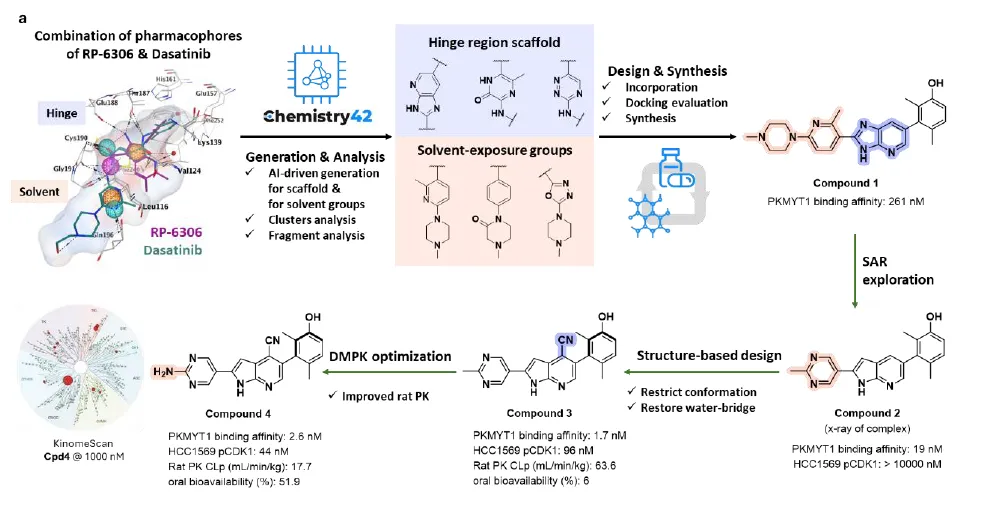
英矽智能利用自有Chemistry42平台及其下属应用,结合40+生成模型设计并优化PKMYT1抑制剂流程图解
一箭双雕的“双效”PROTAC
获得优化的抑制剂之后,研究人员构建了PKMYT1–PROTAC–CRBN三元复合体的三维虚拟模型,用于确定最优的连接子参数。以此为基础,团队再次利用Chemistry42平台,包括分子生成及ADMET打分模块等,开发出用于将化合物4与E3连接酶结合的连接子,并合成了苗头分子D1,初步验证其在细胞内降解速率、选择性和抑制活性等方面的有效性。经过对溶解性、代谢稳定性、口服生物利用度等多项指标的进一步优化,最终获得苗头化合物D16-M1P2。
与传统的PKMYT1抑制剂相比,D16-M1P2能够通过泛素-蛋白酶体系统实现对PKMYT1的完全降解,从而诱导出更持久的细胞效力,在药物洗脱后,其活性可至少维持24小时。此外,D16-M1P2还具有双重作用机制:在低浓度条件下主要通过降解PKMYT1发挥作用,而在较高浓度时则还可抑制残余的激酶活性,从而实现对相关信号通路的全面抑制。
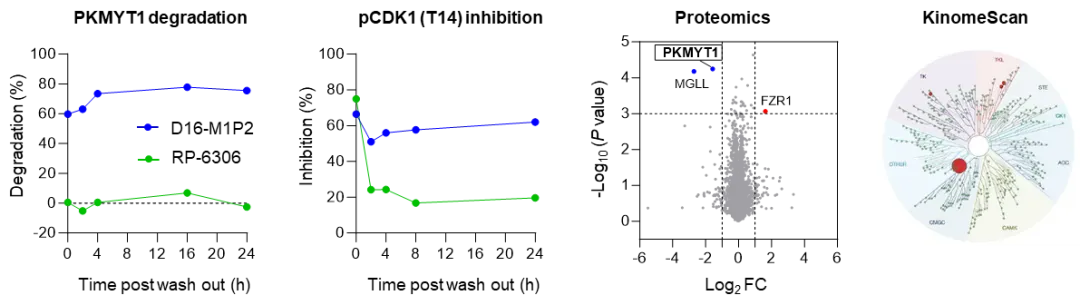
HCC1569细胞中, D16‑M1P2或单纯抑制剂RP‑6306 洗脱后的 PKMYT1、pCDK1 (T14) 水平,蛋白质组学和激酶谱。
在临床前研究中,D16-M1P2表现出良好的选择性、肿瘤抑制活性,以及其他优良成药性:
在HCC1569细胞中,10/100 nM D16-M1P2可特异性的降解PKMYT1;
在1μM浓度时,在测试的403个激酶中仅发现3个大于65%抑制率的脱靶激酶,进一步研究显示选择性均大于50倍;
在异种移植瘤模型中显示出显著的抗肿瘤药效;
在多种临床前动物模型中展现了良好的口服生物利用度。
目前,D16-M1P2已推进至提名临床候选化合物前的验证阶段。值得一提的是,2025年2月,英矽智能在药化领域全球头部期刊Journal Of Medicinal Chemistry中详细发表了第一阶段PKMYT1抑制剂系列的设计优化路径。新的研究将分子类型从小分子抑制剂升级为PROTAC,进一步展示了AI驱动新药研发的广阔前景和实际应用价值。
自2014年成立以来,英矽智能已累计发表超过200篇同行评议论文,这篇最新的PROTAC论文已是今年内第5篇发表于Nature系列期刊的研究论文;接连高水平论文的发表,使其跻身 2025年Nature Index Research Leaders榜单。此外,在药物研发层面,英矽智能在2021至2024年间的自研项目,从立项到提名临床前候选药物(PCC)的平均耗时为12-18个月(传统药物研发需2.5-4年),每个项目仅需合成和测试约60-200 个分子,目前已完成20项候选分子的提名。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 19
19

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 17
17

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 17
17