 研发追踪
研发追踪
 药智网
药智网  2025-12-10
2025-12-10
 539
539
近日,生物制药公司Pharvaris公布了小分子口服速释胶囊deucrictibant在关键3期临床试验RAPIDe-3中的积极顶线结果。
结果显示,在遗传性血管性水肿(HAE)患者中,deucrictibant使症状缓解的中位时间缩短至1.28小时,而安慰剂组则超过12小时。而且,83%的发作仅需单剂药物即可解决。
这一数据表明,该药具备“同类最佳”(BIC)潜力,直指KalVista旗下口服药Ekterly的市场地位。
01
数据突破
Deucrictibant是一种强效、选择性的口服缓激肽B2受体拮抗剂。通过抑制缓激肽信号传导,有望改善HAE发作的临床体征,并预防发作的发生。
RAPIDe-3研究是一项全球性3期、多中心、随机、双盲、安慰剂对照研究,旨在评估口服deucrictibant速释胶囊按需治疗遗传性血管性水肿(HAE)发作(包括非严重喉部发作)的疗效和安全性。
研究结果显示出多项突破性优势。
Deucrictibant组患者的中位症状缓解起效时间为1.28小时,而服用安慰剂的患者这一时间超过12小时(p<0.0001)。
此外,deucrictibant在所有次要终点上同样展现出显著疗效。
发作进展停止的中位时间17.47分钟vs 228.67分钟(p<0.0001)。
以疾病严重程度衡量指标PGI-S来计算,服用deucrictibant后,患者达到“好转”或以上所需时间:2.85小时vs>12小时;达到“改善”或以上所需时间:2.41小时vs>12小时;症状完全缓解的中位时间:11.95小时vs>24小时。这一结果符合市场预期。
值得注意的是,83%的HAE发作仅需单剂deucrictibant胶囊即可缓解,93.2%的deucrictibant治疗后无需使用补救药物。
安全性方面,未出现与治疗相关的严重不良事件,也没有因治疗中出现的不良事件而停用deucrictibant的病例。
这些数据表明deucrictibant能够快速缓解症状,并实现完全消除发作,“为HAE发作治疗提供从始至终的控制”。
02
挑战治疗格局
遗传性血管性水肿(HAE)是一种罕见的、可危及生命的常染色体显性遗传病,以反复发作的皮肤或黏膜下水肿为主要表现。全球范围内,文献报道的HAE患病率约为(1.1-1.6)/10万,目前我国仍然缺乏HAE的流行病学数据。
大多数HAE患者是由于编码C1酯酶抑制剂(C1-INH)的SERPING1基因突变,导致其缺乏或功能障碍。C1-INH是一种天然存在的血浆激肽释放酶抑制剂。C1-INH缺乏会导致血浆缓激肽水平异常升高,引发血管通透性增加和水肿。
HAE的治疗主要可分为急性发作期治疗(按需治疗)和预防性治疗。
目前,国际指南推荐HAE急性期的一线治疗药物为艾替班特(Icatibant)。
这是一种选择性缓激肽B2受体拮抗剂,由武田旗下Shire公司研发,属于一种合成的多肽,与缓激肽结构类似,通过竞争性拮抗缓激肽B2受体,抑制过多的缓激肽导致的皮肤、胃肠道、呼吸道黏膜水肿。
2008年,艾替班特在欧盟获批用于治疗成人HAE的急性发作。2011年获美国FDA批准上市,用于18岁及以上成年人的HAE急性发作治疗。2021年,艾替班特正式在国内获批上市,用于治疗成人、青少年和≥2岁儿童的遗传性血管性水肿(HAE)急性发作,也是国内第一个获批的HAE急性发作期治疗药物。
其3期临床试验结果显示,使用艾替班特后HAE症状显著缓解的中位时间为2.0-2.5 h。
Pharvaris公司开发的deucrictibant也是一种缓激肽B2受体拮抗剂。其优势在于,该药是一种精心设计的氘代小分子口服药物,这是目前唯一处于临床开发阶段的口服缓激肽B2受体拮抗剂。
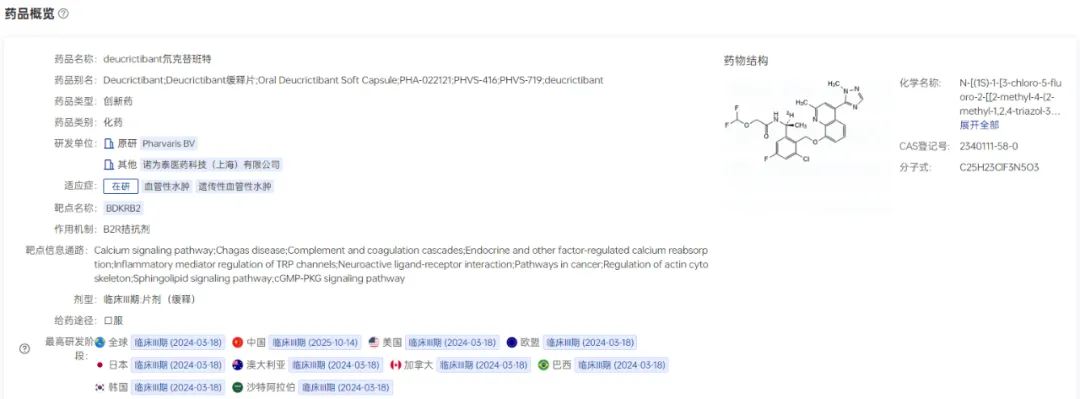
图片来源:药智数据-全球药物分析系统
围绕不同治疗场景,Pharvaris公司开发了两种剂型:用于HAE急性发作的速释胶囊和用于预防的缓释片剂。
目前,deucrictibant速释胶囊已在关键3期临床试验RAPIDe-3中取得积极顶线结果。
对比同靶点的醋酸艾替班特注射液,deucrictibant速释胶囊中位症状缓解起效时间仅1.28小时,显著症状缓解的时间2.41小时,显示出不输于注射剂的疗效。但其更便捷的口服治疗方式,可降低用药门槛,提升患者依从性并提升患者生活质量。
对比已上市的口服HAE按需治疗药物Ekterly,deucrictibant同样展现出优势。
Ekterly(sebetralstat)是KalVista公司开发的一款口服小分子血浆激肽释放酶抑制剂,于今年7月获得FDA批准,是目前美国首个也是唯一获批的口服HAE急性治疗药物。
其3期临床试验显示,Ekterly的300毫克和600毫克剂量组治疗HAE发作时症状缓解的中位时间分别为1.61小时和1.79小时,安慰剂组6.72小时。
尽管跨试验比较可能不可靠,但现有数据表明,deucrictibant在治疗HAE急性发作方面可能更具优势。
Pharvaris计划于2026年上半年提交deucrictibant的上市申请。若成功获批,deucrictibant将为HAE患者提供一种新的口服HAE发作治疗药物。
另外,deucrictibant缓释片用于HAE预防的3期CHAPTER-3研究正在进行。
如果CHAPTER-3在2026年下半年获得积极结果,deucrictibant将可能成为首个同时覆盖HAE预防和急性治疗的口服疗法。
03
结语
虽然HAE是一种罕见病,但随着基因检测与生物标志物检测的普及,确诊率上升,HAE药物市场规模正快速增长。据Evaluate Pharma预测,HAE全球药物市场未来年复合增长率将超过8%。
Pharvaris选择了缓激肽B2受体这一经过验证的靶点,通过口服给药改良,有望实现更广泛人群的可及性,具有显著未满足需求的填补潜力,为患者带来更便捷的治疗选择。Deucrictibant如果成功上市,有望获得可观市场份额。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 15
15

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 14
14

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 13
13