 研发追踪
研发追踪
 药时空
药时空  2025-12-10
2025-12-10
 711
711
随着PD-1抑制剂在肿瘤治疗中逐渐面临耐药挑战,CTLA-4这一老靶点凭借机制创新重新成为行业焦点。近日,BioNTech公布了与OncoC4(昂科免疫)联合开发的新一代CTLA-4抗体gotistobart(BNT316/ONC-392)的Ⅲ期临床试验数据,在PD-1耐药的鳞状非小细胞肺癌(sqNSCLC)患者中展现出显著的生存优势,但安全性问题仍是其商业化之路的关键变量。

gotistobart是一种创新机制的pH敏感性CTLA-4抗体,可以通过pH依赖性的方式选择性清除肿瘤微环境(TME)中的Treg,从而达到有效性和安全性的更优平衡。该药由OncoC4研发,2023年3月,BioNTech与OncoC4达成合作开发协议,OncoC4收到2亿美元预付款,以及额外的里程碑和双位数百分比销售分成。
据新闻稿显示,gotistobart在全球Ⅲ期临床试验PRESERVE-003(NCT05671510)中,针对已接受免疫治疗加化疗的sqNSCLC患者,其死亡风险降低了一半以上,安全性可控;在随访近15个月时未达到中位OS,而化疗中位OS为10个月。
PRESERVE-003是一项两阶段开放标签的Ⅲ期临床试验,旨在评估gotistobart单药治疗,对比标准治疗化疗方案(多西他赛)的疗效与安全性,试验对象为接受PD-(L)1抑制剂和铂类化疗的sqNSCLC患者。
该试验的非关键性阶段最初纳入了所有类型的非小细胞肺癌患者。目前正在开展的关键性阶段,则专门招募sqNSCLC患者。此阶段计划在澳大利亚、比利时、加拿大、中国、德国、意大利、荷兰、西班牙、韩国、土耳其、英国和美国等多个国家和地区的临床试验中心入组约500名患者。主要终点是整体生存期(OS)。次要终点包括总体缓解率(ORR)、无进展生存期(PFS)和安全性。预计主要完成日期为2026年6月。
该Ⅲ期试验非关键性阶段的分析,纳入了45名接受gotistobart单药治疗的sqNSCLC患者,对照组为42名接受化疗(多西他赛)作为二线及以上全身治疗的sqNSCLC患者。截至2025年8月8日数据截点数据如下:
12个月总生存(OS)率:gotistobart组63.1%,多西他赛组30.3%。
中位随访14.5个月时:gotistobart组中位OS尚未达到,多西他赛组中位OS为10个月。
与多西他赛组相比,gotistobart组将患者的死亡风险降低了54%(风险比HR=0.46,95% 置信区间CI:0.25–0.84;名义P值=0.0102)。
安全性方面,与既往数据一致,且可控。≥3级治疗相关不良事件(TRAEs):gotistobart组为19/45(42.2%),多西他赛组为20/41(48.8%)。
值得注意的是,BMO资本市场分析师在了解了gotistobart的数据后,在给投资者的说明中表示,疗效结果强劲,但缺乏关于免疫相关毒性的全面数据,使得一个关键的耐受性问题尚未得到解答。
尽管Ⅲ期数据表明耐受性仍是一个问题,但TD Cowen分析师认为整体状况令人鼓舞,考虑到目标非小细胞肺癌(NSCLC)人群中尚未满足的需求。分析师表示:“目前数据表明gotistobart具有坚实的疗效,且被低估,但有潜力成为二线鳞状NSCLC的可行选择。”“这对公司来说可能是个不错的商业机会,因为公司正逐步推进推出自有的肿瘤学项目。”
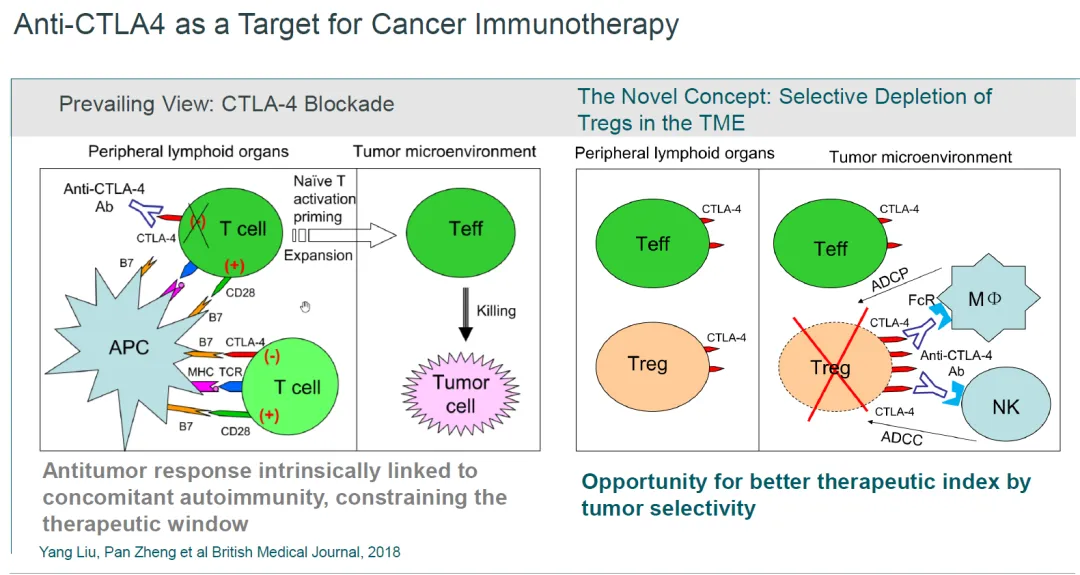
目前,全球获批的CTLA-4单抗仅有两款,分别是百时美施贵宝的Ipilimumab(Y药)和阿斯利康的Tremelimumab。而安全性问题是制约CTLA-4抗体发展的核心瓶颈之一。早期CTLA-4抗体的作用机制直接:通过无差别抑制削弱Tregs的免疫抑制作用,进而激活全身免疫反应。缺点就是无法区分肿瘤与正常组织中的Tregs,易引发严重的免疫相关不良反应(IrAEs)。
尽管发展受限,CTLA-4的研究从未停滞,而是朝着精准化方向转型。BioNTech从OncoC4引进的gotistobart正是这一转型思路的典型代表,其分子设计通过双重创新实现了对传统CTLA-4抗体的突破。该产品也是BioNTech构建下一代IO治疗体系的关键布局。
当然,国内创新药企也在加速布局CTLA-4领域。如信达生物的IBI310(伊匹木单抗)是我国首个自主研发的CTLA-4单抗,目前已在中国提交上市申请。
总的来说,CTLA-4凭借独特的免疫调节机制与持续迭代的药物研发,有望摆脱PD-1的阴影。对于行业而言,gotistobart的研发历程也为CTLA-4抑制剂的发展提供了宝贵经验,推动肿瘤免疫治疗向更精准、更安全的方向迈进。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 15
15

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 14
14

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 13
13