 研发追踪
研发追踪
 医麦创新药
医麦创新药  2025-12-13
2025-12-13
 608
608
昨日(12 月 11 日),邦耀生物基于具有自主知识产权的通用型细胞平台(TyUCell®)开发的新一代异体 UCAR-T 产品「靶向 CD19 基因修饰的异体嵌合抗原受体 T 细胞注射液」(BRL-303)获 CDE 临床默示许可,拟开发治疗中度或重度难治性系统性红斑狼疮(rSLE)。
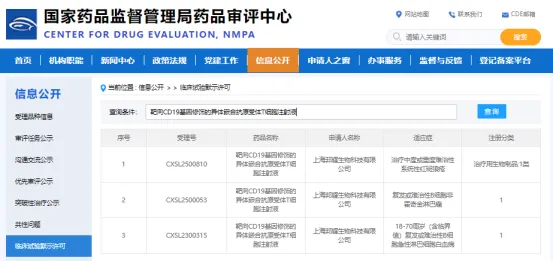
▲ 图片来源:CDE 官网截图
BRL-303 是全球首款在研究者发起的临床试验(IIT)中,针对自身免疫性疾病显示出疗效的异体通用型 CAR-T 产品,标志着其在血液肿瘤领域双适应症(B 细胞非霍奇金淋巴瘤及 B 细胞急性淋巴细胞白血病)获批临床后,向自免治疗领域的重要拓展。
BRL-303 主要通过多重基因编辑技术实现异体 T 细胞的免疫逃逸和功能优化,既从源头规避了移植物抗宿主病(GVHD)和宿主排斥(HVG)风险,又能精准靶向调控 SLE 患者体内异常活化的免疫细胞、重建免疫平衡。
该 UCAR-T 技术是由邦耀生物创始人 & 董事长、华东师范大学刘明耀教授以及杜冰教授领衔的科学家团队历经 8 年科研攻关、多次技术迭代所研发,具备三大核心优势:
1. 可及性高:无需自体细胞采集与定制化生产,单批次可满足 200 例以上治疗需求,支持「即取即用」,大幅缩短等待时间;
2. 安全性优:不同于传统治疗方案的强免疫抑制,其无需对患者进行额外的清淋或者免疫抑制,仅采用常规甚至更低的清淋方案,就可以实现对靶细胞的完全清除,还能够有效避免对患者过度免疫抑制所带来的感染、粒细胞缺乏、淋巴细胞恢复慢等风险。
3. 持久性好:精选健康供体 T 细胞并优化扩增工艺,使其在患者体内具备更强的增殖能力和长效存续性。
此前,BRL-303 治疗 SLE 已在两项 IIT 临床研究中展示了显著的临床疗效,相关研究成果已于 2025 年分别发表在国际著名期刊 Cell Research 和 Med。值得一提的是,其治疗 3 例难治性自免疾病患者的研究成果于 2024 年 7 月发表在顶级期刊 Cell,成为全球首个报道应用于临床并成功治疗自免疾病的异体通用型 CAR-T 的临床在研产品。
2025 年美国风湿病学会(ACR)公布的最新数据显示,截止 2025 年 3 月 16 日,4 例 rSLE 患者接受 BRL-303 治疗后,原有 SLE 的临床体征和症状均得到显著且持续的改善。
具体表现为在治疗后的 3 至 6 个月内,实现了 SELENA-SLEDAI 评分归零且 PGA 评分<1,表明了患者的 SLE 疾病活动度得到根本性控制。并且所有受试者在一个月内血清 ds-DNA 水平显著下降,补体 (C3 和 C4) 水平出现上升;与此同时,蛋白尿在所有受试者中也得到了缓解。值得注意的是,有 1 例患者经治疗后 3 个月时停用了所有激素和免疫抑制药物,实现了无药物缓解。
此外,接受 BRL-303 输注治疗整个过程耐受性良好,且治疗后所有受试者仅出现 1 级 CRS, 均未观察到免疫效应细胞相关神经毒性综合征(ICANS)和 GVHD,体现了优异的临床安全性。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 15
15

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 14
14

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 13
13