 研发追踪
研发追踪
 医药魔方Pro
医药魔方Pro  2025-12-18
2025-12-18
 741
741
肝细胞癌(HCC)治疗领域迎来里程碑式创新突破。
12月15日,剂泰科技自主研发的开创性mRNA编码的双特异性T细胞衔接器(TCE)疗法MTS105相关成果,在Nature Communications杂志正式发表,下一代in vivo TCE疗法赛道杀出一匹“黑马”。
研究数据显示[1],MTS-105在小鼠、大鼠和食蟹猴模型中,组织特异性药物富集显著优于对照的抗体型TCE;在食蟹猴实验中,所有受试动物在测试剂量下均耐受良好,其独特的表达动力学可支持每周一次给药;小鼠模型数据显示,在低至0.15μg剂量下,实验小鼠实现100%完全缓解,肿瘤完全清除;MTS-105治愈(无瘤)小鼠在再次接种新肿瘤后仍保持无瘤状态,显示出长期免疫记忆效应。
机制研究显示,体内mRNA编码的不带Fc设计的TCE可以更好地调控T细胞活化和分化,防止过度激活导致的细胞凋亡和功能衰竭。
目前,MTS-105已经进入临床开发阶段,有望成为全球首款CD3/GPC3靶向mRNA编码TCE实体瘤疗法。

突破HCC治疗困局
肝细胞癌(HCC)是全球癌症相关死亡的重要原因之一,多数患者确诊时已进展至不可切除阶段,预后极差。当前,晚期HCC的治疗选择依然有限,即便是一线标准疗法(如阿特珠单抗+贝伐珠单抗),其中位总生存期与无进展生存期仍不尽如人意,客观缓解率普遍低于30%,临床亟需更高效、更安全的创新治疗方案。
在众多潜力靶点中,GPC3因其在超70%的HCC肿瘤中特异性高表达、而在成人正常组织中表达极低,被视为HCC免疫治疗领域的理想靶标。根据医药魔方NextPharma®数据库,全球肝细胞癌在研药物超700款,其中70余款聚焦于GPC3靶点,技术路径涵盖单抗、双抗(包括TCE)、ADC、CAR-T细胞疗法、疫苗等,群雄逐鹿的格局已然成型。
尽管全球管线研发百花齐放,但目前尚无GPC3靶向药物获批上市,传统技术路线也面临多重挑战。以在血液肿瘤中斩获佳绩的双特异性TCE为例,其在进军实体瘤领域时遭遇了双重壁垒:一方面,其需要极高的系统暴露量才能保证药物在肿瘤部位的有效渗透,极易引发细胞因子释放综合征(CRS)等严重毒副作用;另一方面,肿瘤内的药物实际富集效率低,例如传统抗体TCE(如ERY974)在肿瘤组织中暴露受限,导致其疗效受到限制。
在此背景下,剂泰科技的“mRNA编码的TCE”技术有望彻底打破传统僵局,针对CD3/GPC3靶点,剂泰科技的MTS105项目进展位居全球首位,目前已完成GLP毒理学研究,并启动了首项由研究者发起的临床试验(IIT),标志着其正式进入临床开发阶段(NCT06689540)。
MTS105的设计逻辑可类比“特洛伊木马”战术:编码双特异性TCE的mRNA由肝靶向LNP精准递送至肝脏,并在被肝细胞摄取后在体内原位持续、大量表达与分泌TCE。由此产生的TCE能高效渗透实体瘤,在局部建立稳定的高暴露水平,进而充分激活和招募T细胞对肿瘤细胞实施定向杀伤。
相较而言,传统蛋白类双抗或免疫疗法依赖全身静脉给药,往往难以穿透实体瘤致密的基质屏障,造成瘤内暴露不足;因此,为弥补渗透不足就需要更高的系统性剂量,又会带来不必要的全身暴露与相关毒性风险。MTS105的“特洛伊木马”策略从根本上改变了传统“外部攻城”的模式,通过在肝脏肿瘤区域持续生成并输送活性分子,有效克服了实体瘤递送的关键瓶颈,使药效更精准聚焦于肿瘤微环境,显著提升了治疗选择性与安全性。
与传统治疗策略相比,mRNA编码的TCE技术展现出以下优势:
1)体内高效表达:mRNA能在体内直接编码并生成功能性TCE,绕过了复杂的体外蛋白生产和纯化流程,在简化工艺的同时,改善了药物的表达动力学与生物利用度;
2)肝脏靶向递送:LNP递送系统可精准地将mRNA递送至肝脏肿瘤区域,最大限度地减少全身性脱靶风险;
3)良好的安全性:临床前研究表明,在有效治疗剂量下,实验动物未观察到显著的不良反应,预示着其潜在的良好安全性;
4)强效抑瘤效果:能够实现剂量依赖性的完全肿瘤消退,展现出显著的抗肿瘤活性。
全球首款CD3/GPC3 mRNA TCE疗法
在这篇最新发表于Nature Communications的研究中[1],剂泰科技的研究团队首先从NanoForge的数据心脏千万级脂质库中,筛选出新型候选分子MLX0473。实验数据证实,MLX0473-LNP的mRNA递送效率与蛋白表达水平均显著优于对照组,展现出更高效、更持久的表达特性。
基于此,剂泰团队成功构建了mRNA-LNP药物MTS105。通过对其mRNA序列的优化,MTS105能在体内表达靶向GPC3×CD3的双特异性TCE。尤为关键的是,MTS105首次验证了无Fc区设计的双特异性抗体在T细胞激活中的独特优势,该设计能够避免反复刺激导致的T细胞凋亡与耗竭,从分子层面为其可靠的安全性及持久的疗效奠定了基础。
有效性方面,在免疫健全、具有人源CD3 T细胞的肝原位肿瘤小鼠模型中,MTS105展现出显著的抗肿瘤效果。在低至0.15μg/小鼠的剂量下,实验小鼠实现100%完全缓解(CR),肿瘤被完全清除。0.5μg/小鼠的剂量下,84天随访期内未见复发。相比之下,传统的抗体类TCE(ERY974)在1mg/kg(约20μg/小鼠)剂量下仅表现出约50%的肿瘤生长抑制。
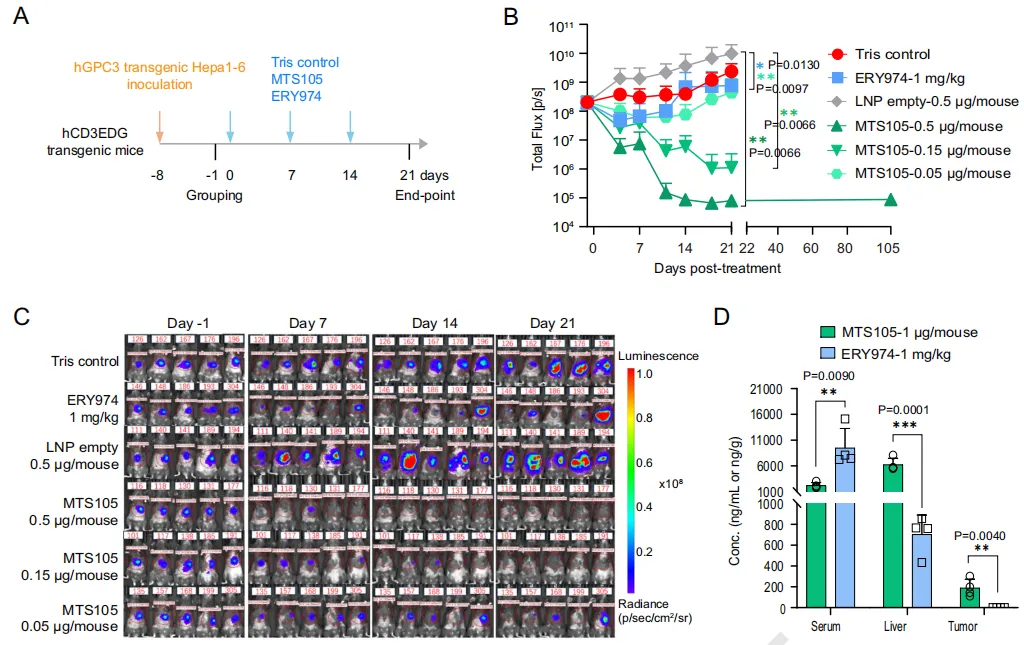
MTS105在肝原位癌模型中的有效性数据
安全性方面,MTS105在小鼠、大鼠及食蟹猴模型中均表现优异,其肝脏药物暴露量显著高于血浆,实现了高度的组织特异性富集,安全性优于传统抗体TCE。
在食蟹猴实验中,MTS105展现出良好的线性药代动力学特征,所有受试动物在测试剂量下均耐受良好,未出现严重不良反应。MTS105独特的缓释特性可支持每周一次给药,有望提升患者依从性。
研究还发现,在肿瘤完全消退的小鼠体内再次接种同类癌细胞时,小鼠能保持长期无瘤状态。免疫表型分析显示,其外周血及脾脏中的CD8+效应记忆T细胞群显著扩增。这表明MTS105不仅能直接清除肿瘤,更能重塑机体免疫系统,建立起可长期持续的保护性免疫记忆。
结合mRNA技术规模化生产的优势及剂泰科技自研递送平台的可复用能力,MTS105的产业化前景值得期待,具备拿下全球首款CD3/GPC3靶向mRNA编码TCE疗法的实力。
“火箭+卫星”研发新范式
成立于2020年的剂泰科技是全球最早布局AI+药物递送赛道的公司之一。9月16日,剂泰科技正式发布全球首个AI驱动的纳米递送平台NanoForge,首次官宣“火箭(LNP)+卫星(mRNA)”的研发新范式。NanoForge平台核心由三大模块构成:1)AiLNP(AI核酸递送系统设计);2)AiRNA(AI mRNA序列优化);3)AiTEM(AI小分子制剂设计)。
截至目前,公司已拥有超过1000万种的脂质结构,10万个可做模型训练的数据点,并已突破性成功开发靶向人体内肝、肺、免疫器官、心脏、肌肉、肿瘤、中枢神经系统、胃肠道8个器官或组织的LNP,获得授权和已备案专利申请超过100项。
MTS105正是剂泰科技“火箭+卫星”范式的第一个官宣代表作。
与聚焦肝脏靶向的MTS105相呼应,剂泰科技利用同一平台开发的MTS107则实现了脾脏靶向递送的突破,其相关研究成果已于9月17日发表于Journal for ImmunoTherapy of Cancer杂志[2]。

MTS107在mRNA抗原设计上完成了原创性升级,通过引入新型佐剂,显著提升了抗原提呈效率与特异性T细胞的抗肿瘤活性。临床前研究表明,在HPV16+
TC-1及HPV18+ MC38等小鼠模型中,这款治疗性mRNA疫苗能够剂量依赖性地诱导HPV特异性CD8+ T细胞扩增与瘤内浸润。
作为单药,其对晚期肿瘤的最高生长抑制率高达71.79%;当与抗PD-1抗体联用时,更是实现了100%的完全缓解,且未观察到明显的体重下降或严重不良反应,为HPV相关宫颈癌、头颈癌等患者提供了全新的突破性治疗方案。
MTS107联用策略的潜力也在Nature近日发表的研究中得到了侧面印证[3]。数据显示,叠加接种mRNA新冠疫苗的患者三年生存率几乎是未接种的两倍,其核心机制与MTS107联合治疗异曲同工:mRNA疫苗作为一种高效的免疫激活剂,能协同PD-1产生更持久、更广泛的特异性抗肿瘤免疫。
基于“火箭+卫星”这一新范式,剂泰科技已成功构建了覆盖肿瘤、代谢、自身免疫及中枢神经系统疾病等多个关键领域的多元化管线布局,目前已开发超10个管线项目。其核心技术展现出高复用性,如MTS105所验证的肝脏靶向LNP技术可无缝延伸至肝脏疾病管线的开发中,而积累的mRNA优化经验则能为多款TCE疗法的快速推进提供坚实支撑,形成了平台赋能管线、管线反哺平台的良性协同效应。
剂泰科技今年完成了由北京市医药健康产业投资基金和大兴区产业投资基金联合领投的4亿元人民币D轮融资,累计融资超3亿美元,是国内纳米递送赛道的“融资王”,此前得到红杉、中金、峰瑞资本等多轮领投和跟投。
公司创始团队包括美国工程院院士陈红敏博士,MIT科学家赖才达博士和王文首博士,核心团队均为各领域实战经验丰富的老兵,扎实的技术积淀与全球产业视野为平台的持续迭代与管线的快速推进奠定了坚实基础。
在研发布局上,剂泰科技已在杭州、北京及美国剑桥建立起三大研发中心,兼顾国内产业链优势和临床前研究与临床试验资源,同时通过海外中心紧密链接全球最前沿的技术与一线国际药厂资源,可见剂泰科技眼望全球首创的志向和实力。
公司联合创始人兼CEO赖才达曾讲到,剂泰科技的愿景是做生物世界的SpaceX,以不同的纳米火箭,用类似SpaceX的商业驱动模式,既提供火箭的服务,与大药厂和biotech合作产品开发,又自研“火箭+卫星”系列突破性管线产品。
结语
从AI驱动的NanoForge纳米递送平台,到mRNA编码TCE的创新疗法模式,剂泰科技正以MTS105为突破起点,重新定义癌症等疾病的未来治疗格局。这座高效运转的“火箭+卫星”工厂,有望加速产出更多潜在first-in-class爆品。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 7
7

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 7
7

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 8
8