 研发追踪
研发追踪
 新药猎人笔记
新药猎人笔记  2025-12-22
2025-12-22
 763
763
2025 年 12 月 16 日,上海——美国 Bothell 总部的新兴肿瘤精准疗法公司 Immunome Inc.(NASDAQ: IMNM)宣布,其关键 III 期 RINGSIDE 试验(NCT04871282)获得压倒性阳性结果:口服、每日一次的 γ-分泌酶抑制剂(GSI)varegacestat 在治疗进展性硬纤维瘤(desmoid tumors)患者中,较安慰剂显著延长无进展生存期(PFS),风险比(HR)0.16,p<0.0001,相当于疾病进展或死亡风险降低 84%。


首次消息影响,该公司股价大涨15%。
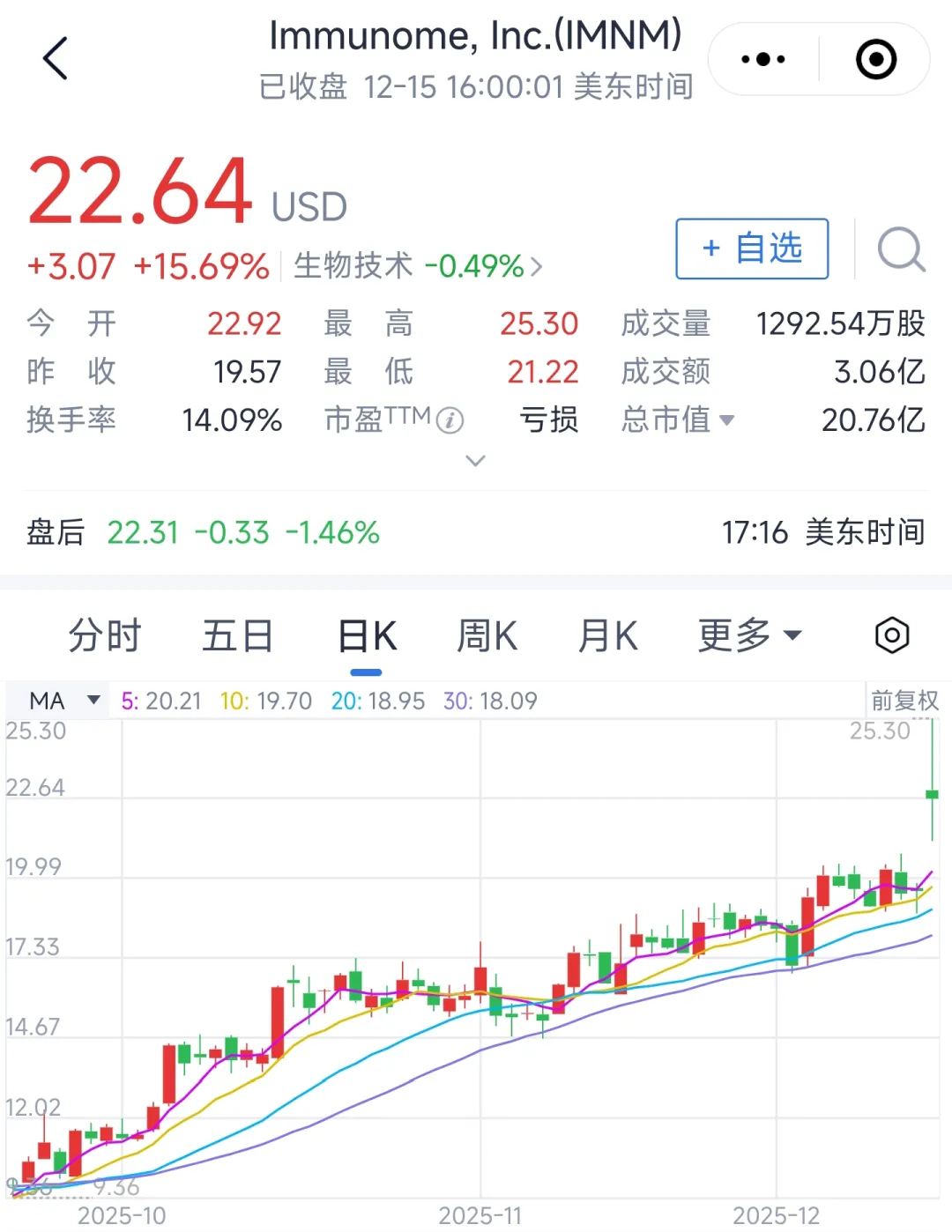
主要终点与全部关键次要终点均达标:
- PFS:独立盲法评估显示,varegacestat 组中位 PFS 尚未达到,安慰剂组中位 PFS 为 11.0 个月;HR=0.16(95% CI 0.071–0.375)。
- 客观缓解率(ORR):56% vs 安慰剂 9%(RECIST v1.1,P<0.0001),为迄今硬纤维瘤随机试验中最高缓解率。
- 肿瘤体积变化:探索性分析显示,varegacestat 组中位最佳体积缩小 83%,安慰剂组则增大 11%。
- 疼痛控制:患者报告的最严重疼痛强度亦显著改善,达到关键次要终点。
安全性可控,口服依从性好
药物整体耐受良好,不良事件与 GSI 类别一致,≥3 级毒性低于 10%。最常见 AE(≥30%)为腹泻(82%,多为 1–2 级)、疲劳(44%)、皮疹(43%)、恶心(35%)及咳嗽(34%)。试验未出现因毒性死亡案例。
基于 RINGSIDE 数据,Immunome 计划于2026 年第二季度向美国 FDA 递交新药申请(NDA),并已于 2023 年获得硬纤维瘤适应症的孤儿药资格。公司将在 2026 年重大肿瘤学会议上公布详细疗效与生活质量数据。
RINGSIDE 全球主要研究者、纪念斯隆-凯特琳癌症中心肉瘤专家 Mrinal M. Gounder 博士表示:“硬纤维瘤虽属良性,却常侵袭邻近器官,反复复发令患者身心俱疲。varegacestat 在如此高比例患者中实现深度、持久缓解,有望改写治疗格局,成为新的口服一线标准。”
关于 RINGSIDE 试验:
该研究为随机、双盲、安慰剂对照 III 期试验,共纳入 156 例≥12 岁、疾病进展的硬纤维瘤患者,按 1:1 分配至 varegacestat 1.2 mg 每日一次或安慰剂,治疗直至进展或死亡;主要终点为盲法独立中心评估的 PFS,关键次要终点包括 ORR、第 24 周肿瘤体积变化及疼痛强度。
关于硬纤维瘤:
硬纤维瘤(侵袭性纤维瘤病)是一种局部侵袭性、无转移潜能的罕见软组织肿瘤,全球年发病率约 0.4/10 万。手术、放疗或酪氨酸激酶抑制剂为现行手段,但复发率高,临床亟需高效低毒的新药。
结束语:
随着 varegacestat 率先在 III 期舞台交出“HR 0.16、ORR 56%”的亮眼答卷,硬纤维瘤患者有望在 2027 年迎来首款针对性口服疗法。
英文链接:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 7
7

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 7
7

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 8
8