 研发追踪
研发追踪
 医麦创新药
医麦创新药  2025-12-29
2025-12-29
 771
771
近日,阿斯利康与第一三共宣布,双方联合开发的重磅 ADC 药物德曲妥珠单抗(Enhertu)获美国 FDA 授予突破性疗法认定(BTD),用于治疗接受新辅助治疗后乳腺和/或腋窝淋巴结仍存在残留侵袭性疾病、且具有疾病复发高风险的 HER2 阳性早期乳腺癌成年患者。

德曲妥珠单抗是采用第一三共的独有技术设计的一款靶向 HER2 的 DXd ADC。2019 年 3 月,第一三共与阿斯利康达成了一项 69
亿美元的合作,在全球范围内共同开发和商业化该产品。
此前,德曲妥珠单抗已获得 FDA 批准 8 项适应症,涉及 HER2 阳性乳腺癌(一/二/三线)、HER2 阳性胃癌(二/三线)、HER2 低表达乳腺癌(二线)、HER2 突变非小细胞肺癌(二线)、HER2 低表达或 HER2 超低表达乳腺癌等等。
本次 FDA 授予 BTD 主要是基于一项头对头恩美曲妥珠(T-DM1)的临床 3 期试验 DESTINY-Breast05 的结果。该结果于 ESMO 2025 年会的主席研讨环节公布,并同步发表于《新英格兰医学杂志》。
该研究结果显示,与活性对照药物相比,Enhertu 在接受过新辅助治疗后仍存在乳腺或腋窝淋巴结侵袭性残留、且复发风险较高的 HER2 阳性早期乳腺癌患者中,统计学显著且具有临床意义地提升了无侵袭性疾病生存期(IDFS)。
具体而言,德曲妥珠单抗组 3 年 IDFS 高达 92.4%,优于现有标准方案 T-DM1 的 83.7%。
与 T-DM1 相比,接受德曲妥珠单抗治疗的患者,其远处复发(包括中枢神经系统复发)和局部区域复发的发生率都更低。
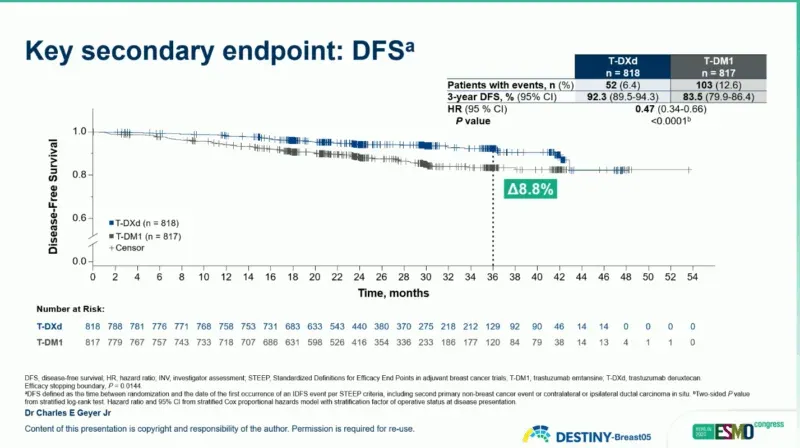
▲ DESTINY-Breast 05 研究的 DFS 数据
在关键次要终点方面,德曲妥珠单抗组的 3 年无病生存率(DFS)也相较于 T-DM1 组有显著获益(92.3% vs 83.5%;HR=0.47;95%Cl 0.34-0.66)。远处无复发生存期(DRFI)方面,德曲妥珠单抗组和 T-DM1 组的 3 年 DRFI 分别为 93.9% 和 86.1%(HR=0.49;95%Cl 0.34-0.71)。此外,德曲妥珠单抗组和 T-DM1 组的 3 年无脑转移复发间期(BMFI)分别为 97.6% 和 95.8%(HR=0.64;95%Cl 0.35-1.17)。目前总生存期(OS)数据尚不成熟。
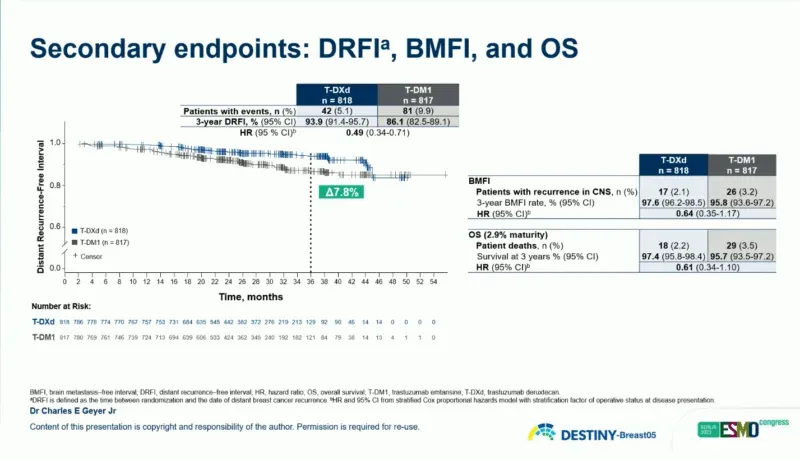
▲ DESTINY-Breast 05 研究的 DRFI、BMFI 和 OS 数据
继今年早些时候公布的 3 期 DESTINY-Breast11 研究之后,这是德曲妥珠单抗在 HER2 阳性早期乳腺癌领域获得的第二项 3 期试验积极结果。公司已在推进相关监管申报。
原文:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 7
7

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 7
7

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 8
8