 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2025-12-27
2025-12-27
 16
16
今年,美国FDA批准了2款siRNA新药,至此全球已有8款RNAi产品获得监管批准。
回顾RNAi的监管历程,从2018年8月首款siRNA药物patisiran(Onpattro)获得FDA批准,打破了RNAi技术在递送难题凸显和资本相继退出的黑暗时期,到如今2025年,7年多的时间,已经有8款siRNA新药获得监管批准——siRNA药物已经成为创新药中重要的组成部分,给多种亟待治疗选择的患者提供了治疗机会。
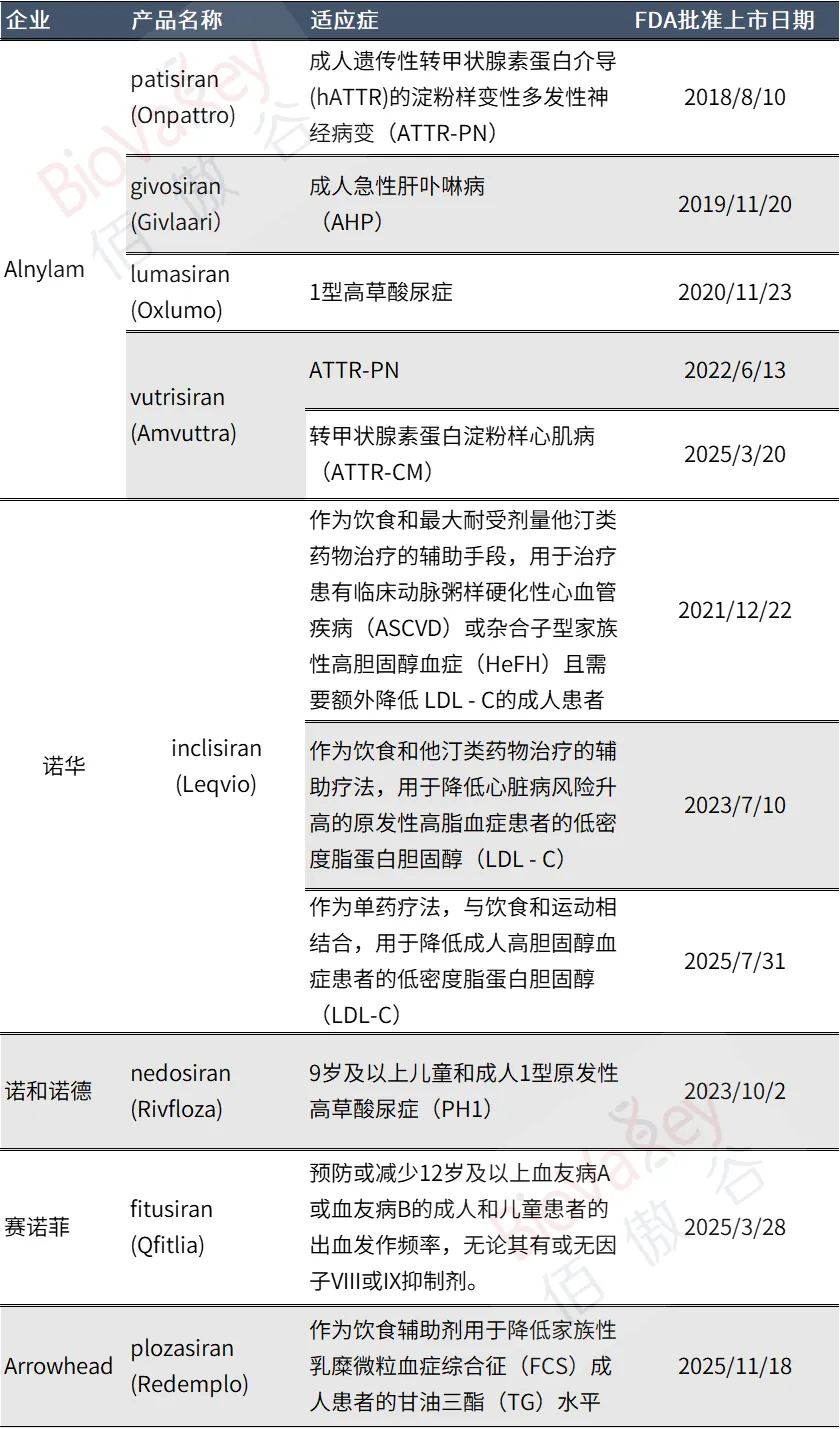
随着越来越多RNAi产品的面世,其适应症范围逐渐广泛,其竞争格局也发生了极大的变化。
ATTR-PN/CM
遗传性转甲状腺素蛋白介导的淀粉样变性多发性神经病(ATTR-PN)/淀粉样心肌病(ATTR-CM),是RNAi技术最先攻克的疾病,同时也是竞争最为激烈的适应症。
Alnylam的首款siRNA产品Onpattro于2018年8月获批治疗hATTR-PN后,Alnylam于2022年6月推出了hATTR-PN的迭代产品Amvuttra;由于新一代药物Amvuttra给药间隔时间长,患者的依从性更好,患者快速完成换药后,Onpattro销售下跌,Amvuttra迅速上涨。
在2025年3月,Alnylam终于攻克了一直以来的目标——转甲状腺素蛋白淀粉样心肌病(ATTR-CM),FDA批准了Amvuttra用于治疗ATTR-CM。此前,patisiran针对ATTR-CM的补充申请被FDA拒绝了。
而在ATTR-CM这个适应症上,市场潜力庞大。根据报道,预计到2030年,ATTR-CM市场将达112亿美元,目前约80%患者未被确诊,增长空间显著。
在这个适应症上,Amvuttra面临着来自TTR稳定剂辉瑞的tafamidis(Vyndaqel/Vyndamax)和BridgeBio的Attruby(acoramidis)的直接竞争,同时后续还面临着其他候选药物的竞争,包括来自阿斯利康/Ionis的RNA沉默剂Wainua、Intellia的基因编辑疗法nex-z(不过该药物在近期报告了1例患者死亡事件,目前正处于临床搁置状态)。
急性肝卟啉病
急性肝卟啉病主要的治疗方式包括血红素类药物、高糖类药物、对症治疗药物(例如镇痛药物、抗癫痫药物等)、激素类药物,以及新型靶向药物givosiran(Givlaari)。
由于急性肝卟啉病是一种超级罕见病,其创新药研发管线并不多,givosiran也是近几年唯一获批的急性肝卟啉病的新药。基于此,givosiran的销售增长也颇为乐观,givosiran在2024年的全年销售额为2.56亿美元,同比增长24%。
原发性高草酸尿症1型
原发性高草酸尿1型(PH1)同样是一种较为罕见的疾病,该适应症有两款siRNA药物上市,分别是Alnylam的lumasiran(Oxlumo)和诺和诺德的nedosiran(Rivfloza)。
—lumasiran(Oxlumo):一种靶向羟基酸氧化酶1(HAO1)mRNA的RNAi疗法。lumasiran于2020年11月获得FDA批准,用于治疗原发性高草酸尿1型(PH1)。
—nedosiran(Rivfloza):一种靶向乳酸脱氢酶 A (LDHA) mRNA 的siRNA药物。于2023年10月获得FDA批准,用于治疗9岁及以上儿童和成人1型原发性高草酸尿症(PH1)。
这两款siRNA药物是FDA批准的唯二两款治疗原发性高草酸尿症1型(PH1)的药物。
根据Alnylam财报显示,lumasiran的2023年总销售额达到1.1亿美元,同比增长57%;2024年全年销售额为1.67亿美元。lumasiran的2024年销售额增长缓慢可能是受到诺和诺德nedosiran竞争的影响。目前,诺和诺德尚未公布nedosiran的独立销售额数据。
降脂
2021年12月,诺华的RNAi新药inclisiran(Leqvio)获得FDA批准,为作为饮食和最大耐受剂量他汀类药物治疗的辅助手段,用于治疗患有临床动脉粥样硬化性心血管疾病(ASCVD)或杂合子型家族性高胆固醇血症(HeFH)且需要额外降低 LDL - C的成人患者。
该批准也被视为RNAi开始从罕见病走向大品种治疗的标志性事件。
根据报道,Leqvio的2023年总销售额达到3.55亿美元,同比上涨217%;Leqvio的2024年总销售额达到7.54亿美元,同比上涨114%;2025年前三季度销售额达到8.63亿美元。——已经成为诺华重要的销售额增长动力之一。
在2025年11月18日,FDA新批准了Arrowhead的REDEMPLO(plozasiran)作为饮食辅助剂用于降低家族性乳糜微粒血症综合征(FCS)成人患者的甘油三酯(TG)水平。这是FDA对于RNAi降脂的第二次批准。
血友病
2025年3月28日,美国FDA批准RNAi新药Qfitlia(fitusiran)作为常规预防,以预防或减少12岁及以上血友病A或血友病B的成人和儿童患者的出血发作频率,无论其有或无因子VIII或IX抑制剂。
Qfitlia作为一种RNAi基因沉默疗法,不同于现有的凝血因子代替疗法,Qfitlia直接靶向沉默SERPINC1基因的mRNA,抑制患者肝脏中抗凝血酶的产生,从而减少患者出血。Qfitlia由Alnylam公司原研,后授权给赛诺菲。因此,Qfitlia能够覆盖血友病A和血友病B的患者,拥有更广泛的患者群体。此外,较其他现有的药物,Qfitlia的给药频率更低——每2个月给药1次,并使用伴随诊断测试调整剂量,可能使其具有更好的患者依从性。
在血友病的竞争上,Qfitlia不仅面临着凝血因子代替疗法标准治疗的竞争,同时还面临着血友病基因治疗(包括Hemgenix和Roctavian),以及其他创新药物(如罗氏的FIX/FX双抗Hemlibra)的竞争。
但是根据赛诺菲对Qfitlia的定价,Qfitlia的平均年成本约为642000美元。赛诺菲表示,考虑到折扣、会扣和患者援助计划,Qfitlia的实际成本更低,与其他预防性疗法相当。
小结
实际上,siRNA药物的销售额连年增长,已经成为大型生物制药企业都关注的赛道。从近几年获批的siRNA产品中,就能看到不少制药巨头的身影,包括诺华、赛诺菲、诺和诺德。然而随着这些巨头的涌入以及产品收入,也会激发更多的资本进入RNAi领域。

 产业资讯
产业资讯
 Minhua笔记
Minhua笔记  2025-12-29
2025-12-29
 29
29

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-29
2025-12-29
 30
30

 产业资讯
产业资讯
 一度医药
一度医药  2025-12-29
2025-12-29
 32
32