 产业资讯
产业资讯
 2015-04-07
2015-04-07
 4330
4330
来源:新康界 2015-4-7
近些年来,随着生命科学和生物技术的发展,医药生物技术获得了较大的突破和发展,涌现出了大量的生物药物。生物药物是以现代生命科学为基础,结合基因工程、细胞工程、酶工程、蛋白质工程、发酵工程等手段,从生物体(包括陆地和海洋的动物、植物和微生物)或其组织、细胞、体液中提取得到的用于疾病预防、治疗和诊断的药物总称。生物药物按照药物的生理功能和用途分类,主要分为治疗性生物药物、预防性生物药物、诊断性生物药物和其他生物医药用品。生物药物在人类预防及战胜一系列重大疾病、保障身体健康的进程中发挥着越来越重要的作用,是人类的健康水平迈上了新的台阶。为了全面系统的了解治疗性生物药物的发展历程,笔者系统调研了1986-2014年美国FDA审批的治疗性生物药物,对药物进入了深入的分析,以期对国内从事治疗性生物药物研究的科研人员提供参考。
图1 1986-2014年治疗性生物药物创新程度

1986-2014年美国FDA共审批125个治疗性生物药物,其中首创药物(First in Class )67个,占全部药物的53.60%;优于已有类似药物(Advance in Class)26个,占全部药物的20.80%;模范跟进药物(Addition to Class )32个,占全部药物的25.60%。在药物审批的时间分布上来看,1995年之前审批的治疗性生物药物总体上来说数量较少,1986-1995年十年间共批准了19个。1996年之后随着生物技术的不断发展和完善,治疗性生物药物的审批数量不断增长,并且创药物(First in Class )的数量也较多(见图1)。
依据世界卫生组织药物统计方法合作中心制定的药物解剖治疗化学(Anatomical Therapeutic Chemical)分类系统,从药物适应症的角度出发对1986-2014年美国FDA审批的治疗性生物药物进行了分类。在125个FDA审批的治疗性生物药物中,抗肿瘤药和免疫调节剂39个(31.2%)、胃肠道和新陈代谢药23个(18.4%)、血液系统药18个(14.4%)、骨骼肌系统药12个(9.60%);其次为全身抗感染药9个(7.20%)、诊断试剂6个(4.80%)、神经系统药5个(4.00%)、生殖泌尿系统药和性激素3个(2.40%)、感觉器官药3个(2.40%)、激素类药物(性激素和胰岛素除外)3个(2.40%)、心血管药1个0.80%)、呼吸系统药1个(0.80%)、其他药物2个(1.60%)。抗肿瘤药和免疫调节剂数量最多为39个(31.2%)。首创性抗肿瘤药和免疫调节剂的比例非常高25个(71.43%),明显高于其他种类的药物(见表1)。
表1 1986-2014年治疗性生物药物疾病领域分布
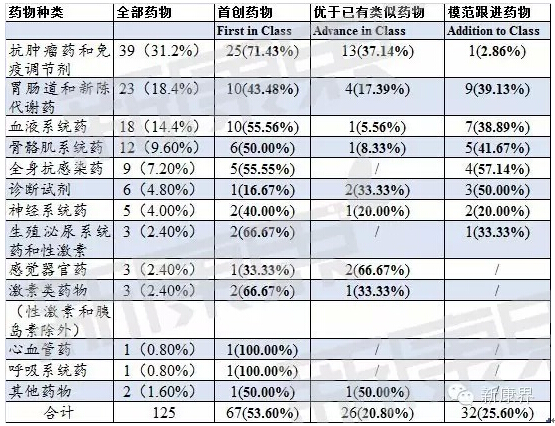
图2 1986-2014年FDA审批治疗性生物药物种类分布
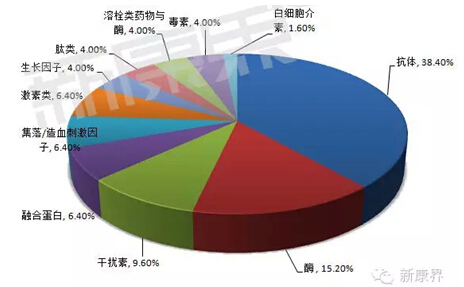
1986-2014年美国FDA审批的125个治疗性生物药物中,抗体药物为48个(38.40%),酶类药物19个(15.20%),干扰素12个(9.60%),融合蛋白类药物8个(6.40%),集落/造血刺激因子类药物8个(6.40%),激素类药物8个(6.40%),生长因子类药物5个(4.00%)、肽类药物5个(4.00%)、溶栓类药物5个(4.00%)、毒素类药物5个(4.00%)、白细胞介素类药物2个(1.60%)。传统的生物药物如重组溶栓类药物、抗凝药物、白介素或促红细胞生成素等在二十世纪八九十年代审批上市的新药数量较多,进入二十一世纪后新药数量逐渐减少,这也从侧面反映出现有产品市场已经基本饱和。抗体药物逐渐成为生物药物的主宰。二十世纪八十年代末,抗体药物仅占生物药物的10%;进入九十年代后随着抗体技术的迅速发展抗体药物在肿瘤、消化、免疫、呼吸、泌尿、骨骼肌疾病、疾病诊断等不同领域广泛应用。1986-2014年美国FDA审批的抗体类药物占全部生物药物的38.40%,2014抗体药物已经占到2014年审批生物药物的55%(见图2)。
图3 1986-2014年美国FDA审批生物药物公司分布情况
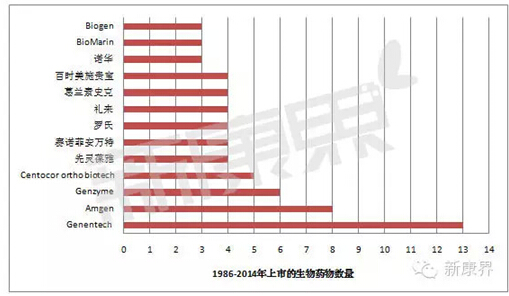
1986-2014年美国FDA审批的125个治疗性生物药物中,Genentech(上市13个药物)、Amgen(8个药物)、Genzyme(6个药物)是其中的佼佼者,三家公司上市的治疗性生物药物数量占全部药物的22%(见图3)。Genentech1987年上市的溶栓药物Activase(阿替普酶)、Amgen1989年上市的贫血药物Epogen都已经成为生物药物中的经典。

 产业资讯
产业资讯
 研发客
研发客  2025-07-24
2025-07-24
 28
28

 产业资讯
产业资讯
 MedTrend医趋势
MedTrend医趋势  2025-07-24
2025-07-24
 31
31

 产业资讯
产业资讯
 胖猫的生命科学札记
胖猫的生命科学札记  2025-07-24
2025-07-24
 31
31