 研发追踪
研发追踪
 2016-03-02
2016-03-02
 5343
5343
来源:医药魔方数据 2016-3-2
一个在研新药往往要通过历时数年的临床研究才能证明其对患者的确切获益。FDA在1992年引入了加速批准(Accelerated Approval)通道,对于一些针对医疗需求未得到满足的严重疾病开发的药物,可基于替代终点批准其上市。
比如一些抗癌药要达到总生存期的临床终点往往需要很长的时间。FDA此时可以把药物在无进展生存期(PFS)方面的获益视为总生存期获益,并以此为依据批准某个药品上市,从而缩短新药的上市时间,让患者更早获得极具希望的新药。近10年(2006-2015)FDA共加速批准了39个药品的新药上市申请(NDA/BLA)。
2006-2015年FDA加速批准的NDA/BLA
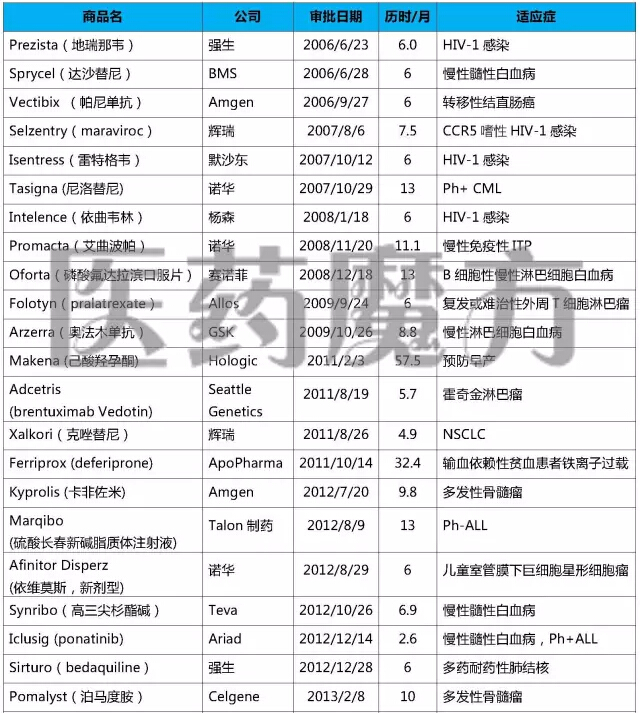
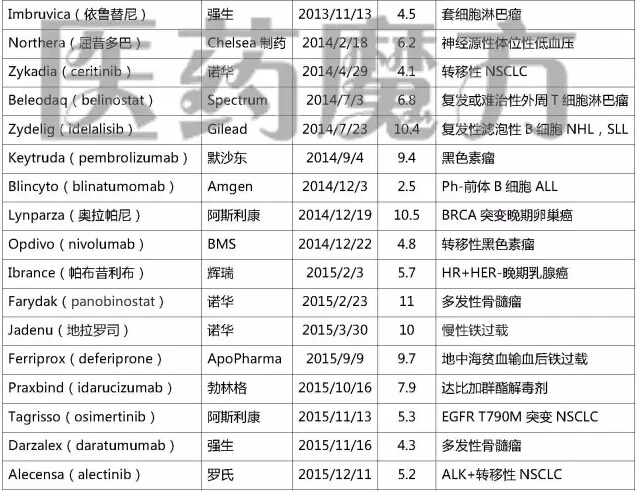
注:上表仅列入获得加速批准的NDA或BLA,不包括加速批准的sNDA或sBLA
上述表格中“历时”指FDA从收到申请到做出批准的时间。经过统计发现,在39个以“加速批准”方式上市的药品中,历时最长的57.5个月,最短的2.5个月。近50%的申请都在6个月内完成审批(19个,49%),超过10个月的申请有9个(23%)。
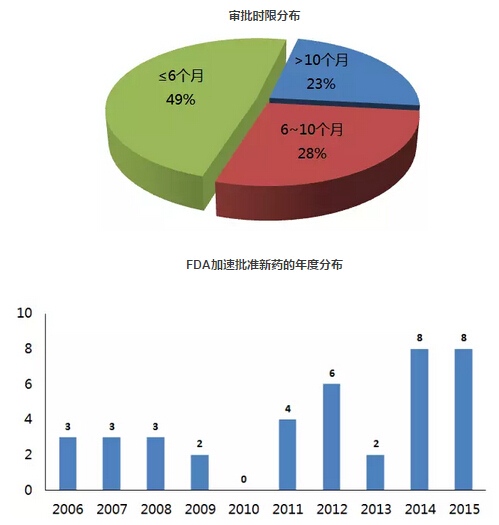
在加速批准情况下,制药企业在药品上市后需要继续进行确证性临床研究,进一步评估药品的临床获益情况。如果上市后验证了临床疗效,则FDA维持原先的批准。

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 267
267

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 257
257

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 247
247