 产业资讯
产业资讯
 2014-10-11
2014-10-11
 3389
3389
来源:生物谷 2014年10月11日
近年来,全球生物药市场增长迅速,在2013年全球品牌生物制剂创造出了累计超过1000亿美元的销售总额,以单抗药物为代表,疫苗、生物治疗类药物(包括核酸药物、细胞治疗、基因治疗)已成为生物制药销售贡献的重要组成部分。
然而随着畅销的生物药专利逐渐到期、新药研发难度的增加以及降低医疗成本压力的需求,生物类似物市场显示出了强劲的发展潜力。据生物医药领域世界著名咨询公司IMS预测,到2015年全球生物类似物市场会达到19~37亿美元的规模,更有其他权威机构大胆预测,2017年的这一数字会达到179亿美元。
2013全球销售前十位的生物类似物
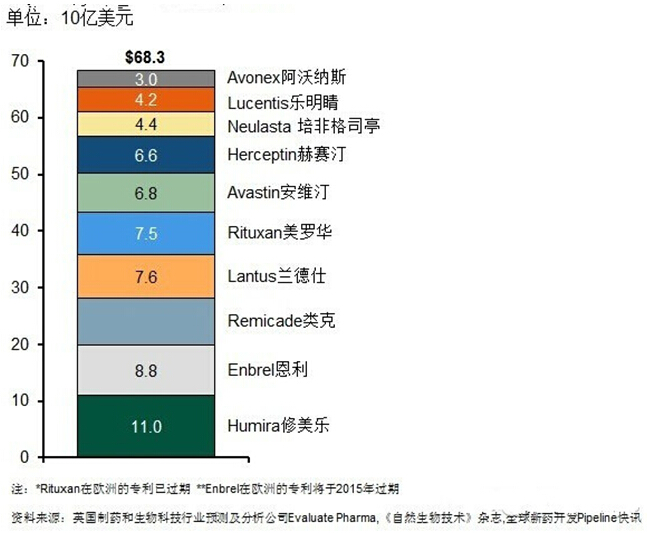
尽管生物类似物表现的巨大"钱"力引得无数企业竞折腰,但世界各国对于生物类似物标准的差异,相应原研药保护的程度等诸多因素政策的制定决定了药企在这些国家的市场"钱"景,因而在追逐巨额利益前,制药企业却不得不考虑各国生物类似物政策这一道门槛的影响。
自2006年以来,欧洲已建立了初具规模的生物类似物审批途径。在2013年,该机构还发布了生物类似物与参比制剂比较的概念文件草案;相关指导原则对临床和非临床的要求也进行了更新和调整,以便申请者在新兴市场开展临床试验时采用。
与此同时,美国FDA对生物类似药的监管态度也日趋明朗。就在今年9月,FDA推出紫皮书(purple book,简称PB,全称翻译成中文名为《包含参比药品排他性和生物类似性或互换性评估的注册生物制品目录》),这一指南的确立为研发人员如何获得官方认可生物类似药的参比生物药品指明了道路,同时也为生物类似药的研发和推进奠定了基石。
在亚太地区,日本已发布了针对生物类似物的监管政策,而且几款产品已在日本获得批准上市。韩国也推出了类似的批准政策。2013年,澳大利亚治疗物品管理局也发布了生物类似物审批的指导原则。很多新兴市场国家都在积极为生物类似物的批准发布相关政策。而巴西、墨西哥、委内瑞拉、哥伦比亚和印度现在至少已经发布了生物类似物审批的草案。
在我国,生物类似物的政策和相关指导原则仍是一片空白,而业界也曾一度盛传年内会出台相关政策。随着生物类似物在市场中的渗透普及,相关政策的出台势必迫在眉睫。

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-09-24
2025-09-24
 14
14

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-09-24
2025-09-24
 14
14

 产业资讯
产业资讯
 同写意
同写意  2025-09-24
2025-09-24
 13
13