 研发追踪
研发追踪
 2015-05-05
2015-05-05
 4519
4519
来源:新康界 2015-5-5
2015年04月份美国FDA共审批通过4种新药,1类新分子实体药物2个; 3类新剂型药物1个;;5类新规格或新生厂商药物1个。
表12015年04月份美国FDA审批通过新药
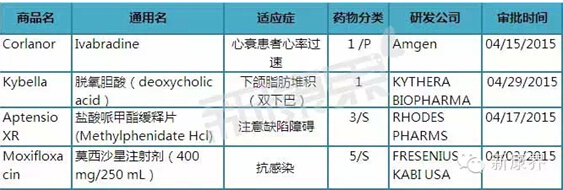
注:1)化学新药分类:1类新分子实体化合物;3类新剂型; 5类药物新规格或新生产商;2)审批分类:P优先评审;S常规评审
(一)心衰患者心率过速新分子实体药物Corlanor(Ivabradine)
2015年04月15日,美国FDA通过优先审批途径批准Amgen公司的心衰患者心率过速新分子实体药物Corlanor(Ivabradine)上市。Corlanor通过阻断超极化激活的环核苷酸门控通道 (hyperpolarization-activated cyclic nucleotide-gated, HCN)而发挥降低心率的作用。当慢性心力衰竭患者左心室射血分数≤35%,窦性心律≥每分钟70次,且使用β受体阻滞剂最大剂量无效或使用β受体阻滞剂存在禁忌时,使用Corlanor(Ivabradine)降低患者心率。
心脏兴奋刺激来源于窦房结(sinoatrial node,SAN),并经结间束传导至房室结(atrioventrieular node,AVN),通过房室结纤维传导至心室浦氏纤维。心脏兴奋起源、传导等障碍是形成心律失常的基础。研究发现在心脏起搏中,有一种在超极化时激活,受环核苷酸调控的离子通道,一般称作超极化激活环核苷酸门控阳离子通道(hyperpolarization-activated and cyclic nucleotide-gate cation channel,HCN)。超极化激活的阳离子电流命名为If(funny current)或Ih(hyperpolarization current)。If 的最重要作用在于使心脏起搏细胞产生自动节律,保证心脏的节律性和规则性跳动,是保证心脏正常的生理功能的前提。If 异常将导致发生心律失常相关性疾病。研究表明可以通过调控If,达到对心脏起搏激动和节律调控。Corlanor通过阻断超极化激活的环核苷酸门控通道(HCN),从而降低心力衰竭患者的心率。
Corlanor(Ivabradine)为片剂,有5mg和7.5mg两种规格。患者初始治疗剂量为每日两次,每次5毫克。治疗2周后基于心率调整剂量。最大给药剂量为每日两次,每次7.5毫克。
(二)下颌脂肪堆积(双下巴)新分子实体药物Kybella(脱氧胆酸)
2015年04月29日,美国FDA批准THERA BIOPHARMA的治疗下颌部脂肪堆积(双下巴)新分子实体药物Kybella(脱氧胆酸)上市。Kybella为皮下注射剂,注射在下颌处的皮下脂肪内,Kybella被脂肪细胞吸收后可以破坏细胞壁从而溶解脂肪细胞。
Kybella注射液的浓度为10mg/ml,每瓶的规格为20mg/2ml。Kybella一个治疗周期需注射6次,每次给药间隔不短于1个月。单次使用时Kybella需在下颌皮下部位注射50针,每针给药0.2ml(共计给药10ml)。给药部位间隔1厘米。
说明:美国FDA审批新药主要是根据药物化学类型和治疗潜能来进行分类的。新药按化学类型主要分为:1类新分子实体化合物(NME),创新性最强。指在美国从未作为药品批准或销售的活性成分,可以是单一成分,也可以是立体异构混合物中的一部分;2类新的衍生物。从已上市的活性成分(即所谓“专利”药)化学衍生而来,即已在美国上市的活性成分的酯、盐或其它非共价键衍生物,或者是去修饰基团的母体化合物未在美国批准上市的;3类新剂型。含有已上市活性成分的新剂型或新处方,其适应症可以与上市产品相同,也可以不同;4类新组合物。含有两种或两种以上已上市的活性成分的品种,上市产品中尚无这种组合;5类药物新规格或新生产商;6类新适应症。由同一家公司或其他公司在美国批准或上市的具有新用途的复制品;7类已上市但未经NDA批准的药品。适应症已与上市产品相同,也可不同;8类变为非处方药;10类适应症不同的新的新药申请。
治疗潜能类分P类和S类两种,是相互独立的两类,即所有的分类中只能包含其中的一个字母。P类:优先评审,治疗上有突破。指1)能有效地治疗或诊断某种疾病,而任何上市产品能给予这种病适当的治疗和诊断;或2)较上市产品更有效、更安全地改善某种疾病的治疗;3)具有适中的、客观的超过上市药品的优越性。如①明显给病人带来较大方便(如减少给药次数),②消除干扰、必要的危险和副作用,③对特定的人群组疾病有效(如老年和儿童病人,或对已用过的药不能耐受的)等。S类:常规评审。治疗效果类似已上市的产品。

 研发追踪
研发追踪
 DailyBio
DailyBio  2025-05-12
2025-05-12
 75
75

 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-05-12
2025-05-12
 77
77
 研发追踪
研发追踪
 药明康德
药明康德  2025-05-12
2025-05-12
 79
79