 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2021-07-01
2021-07-01
 7691
7691
转录因子(Transcription factors,TFs)是一类与基因特定序列专一性结合,从而控制目的基因以特定强度在特定的时间与空间表达的蛋白质分子。作为基因表达调控的重要组成部分,TFs广泛参与体内生理与病理过程。据估计,人类基因组中至少有1600个转录因子,其中约19%与多种疾病密切相关,包括癌症、自身免疫病、糖尿病、心血管疾病等。鉴于TFs对靶基因的直接调控作用,它们相比激酶、GPCR等上游信号蛋白具有更高特异性的疾病调节能力,并可避免信号通路串扰带来的副作用。但除了核受体,TFs缺乏结构稳定的小分子结合口袋和变构调节位点,再者TFs调控机制尚未完全阐明,使之成为蛋白质中“不可成药”靶标的重要组成部分。
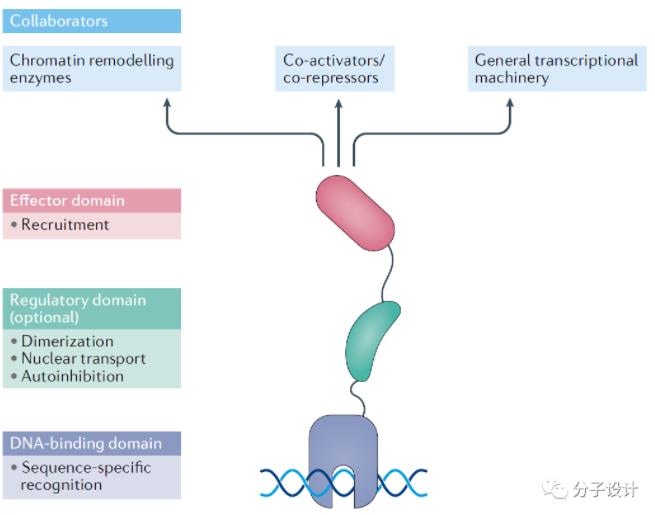
TFs结构从功能上剖析,包含以下不同区域:配体结合域(Ligand-binding domain,LBD),识别特定DNA序列的DNA结合域(DNA-binding domain, DBD),调节二聚化和核定位等过程的调节域(Regulatory domain)以及招募转录激活或抑制因子的效应域(Effect domain)。转录因子在基因表达调控中作用复杂,与表观遗传修饰,基因组三维构像进行多层次的互相调节,高度动态,调控机制尚未完全阐明。转录失调与多种疾病的发生发展密切相关(代表性TF疾病如下表),TFs作为驱动转录程序的关键部分,极具靶向治疗意义。
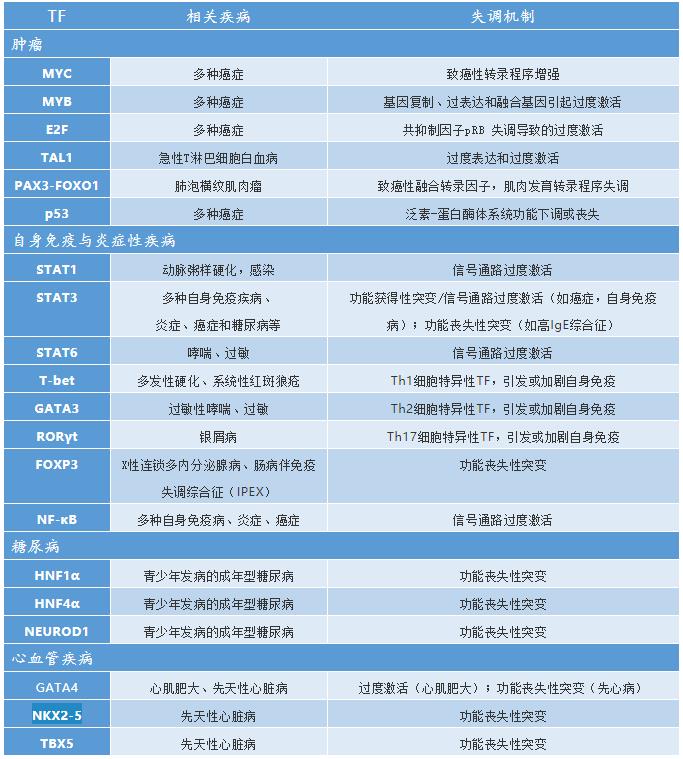
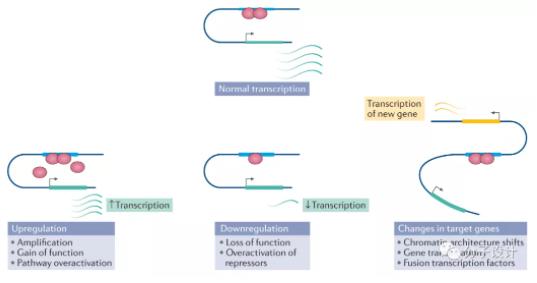
在上述疾病中,部分是过度激活的TFs上调驱动疾病发生发展效应基因的表达,一般通过基因扩增,TF的功能获得性突变,信号通路过度激活来实现。在另一些疾病中,TFs的功能丧失性突变和 TF 阻遏蛋白的过度激活可能会异常下调疾病预防基因的表达。除此以外,染色质结构变化、基因易位、融合转录因子会导致靶基因的遗传突变。
与激酶等其他靶点不同,TFs往往缺乏活性位点和小分子结合口袋,且DBD由于DNA结合表面的正电荷富集和凸面形状,使开发小分子调节剂极具挑战性。因此,许多人认为TFs是不可成药的。随着TFs结构表征、分子生物学、配体设计策略的发展,TFs小分子调节剂的发现与设计取得重要进展。
1. 调节TFs的配体结合域(LBD)
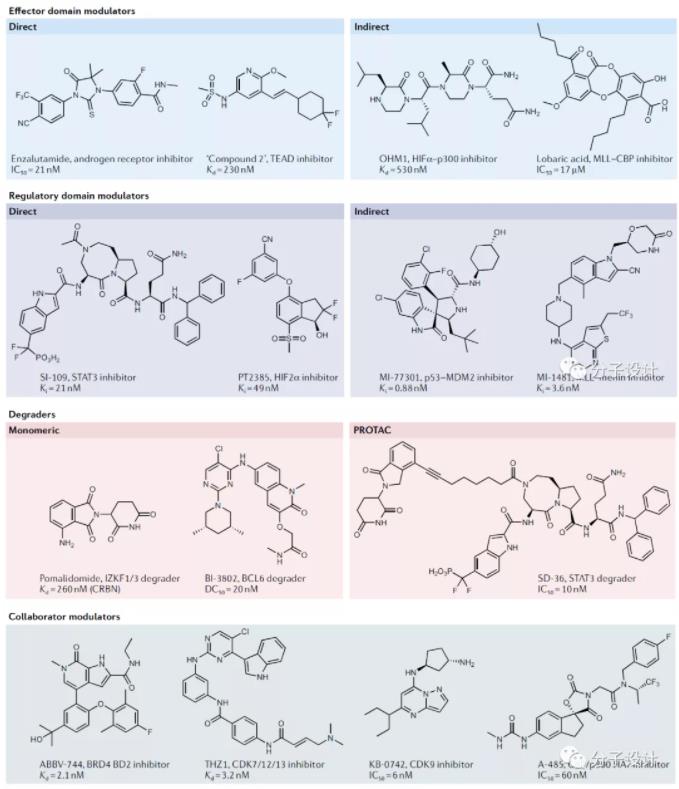
该策略只适用于具有结构良好的LBD的转录因子。最主要的一大类即核激素受体,特定信号分子(例如雌激素、雄激素和糖皮质激素等)与 LBD 的结合通常会通过多种机制激活TF ,靶向LBD能对单个受体进行多种形式的调节(激动、拮抗、反向激动),这使得核受体成为迄今为止最容易成药的TF家族。然而,核受体中也存在着内源性配体未知或无配体结合口袋的孤儿受体,另外一些核受体在疾病中仅表达LBD丢失的剪接变体(如去势抵抗性前列腺癌中的雄激素受体剪接变体AR-V7),导致在LBD进行药物研发的困境。最近,一类来自TEAD家族的转录因子引起了药物研发领域的广泛关注。TEAD家族转录因子作为 Hippo信号通路下游效应子YAP和TAZ的受体,其所包含的YAP结合域(Yap-binding domain, YBD)具有一个可被S-棕榈酰化的疏水结合位点,基于该位点发现了调控TEAD家族TF功能的可能性,如罗氏公司开发了结合该位点的TEAD泛抑制剂,提示YBD结构域的该位点作为TEAD家族转录因子成药的突破口。
2. 调节TF参与的蛋白-蛋白相互作用
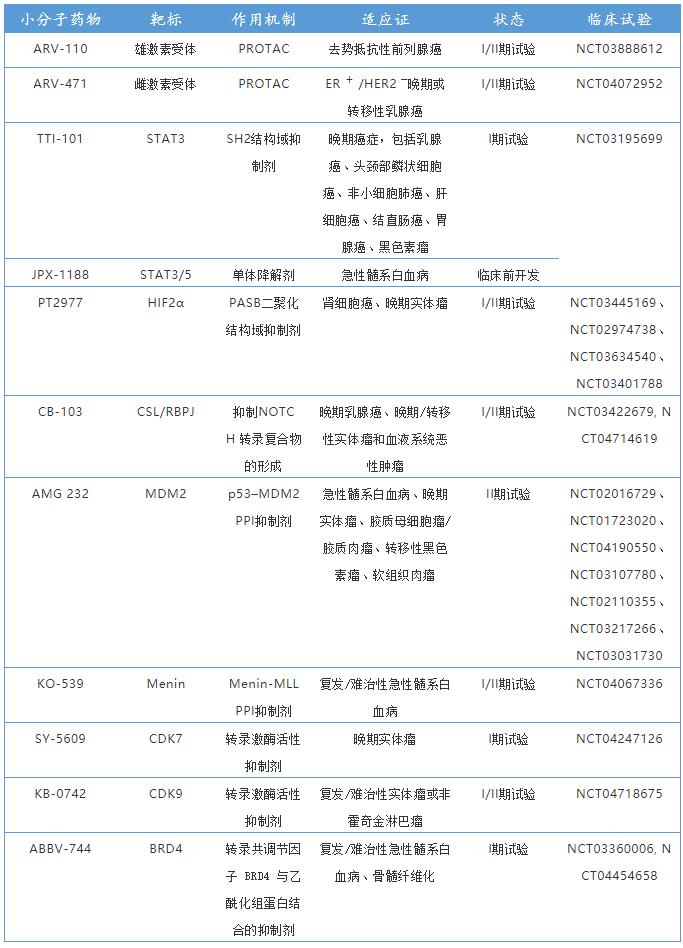
PPI(Protein-protein interaction)是众多TFs进行功能调节与行使的基本过程,调节特定的转录因子PPI是控制转录活性的重要手段。p53-MDM2抑制剂开发是PPI药物研究的一个范例,E3泛素连接酶MDM2负调控抑癌基因p53.不仅结合p53以阻断其肿瘤抑制反式激活域,并调控p53泛素化降解。两者结合位点形成的疏水口袋高度可成药,目前有许多p53-MDM2的肽类和小分子抑制剂,部分已进入临床试验。由于许多转录因子受特定E3连接酶的泛素化调节,靶向E3连接酶与TFs的PPI具有良好前景。如Crews等人开发了VHL-HIF1α抑制剂。TFs通常还依赖稳定的PPI来发挥转录活性,STAT家族就是典型的例子,STAT通过SH2结构域,Tyr磷酸化来形成同源或异源二聚体以驱动转录,目前已有多种JAK抑制剂,STAT3/5抑制剂进入临床阶段。靶向HIF-2α与HIF-1β异二聚化位点的变构抑制剂PT2385和PT2977.转录因子MLL与共激活因子menin的小分子抑制剂MI-538、MI1481等都在相应疾病中表现出治疗潜力。
3. 基于TF的PROTAC靶向降解
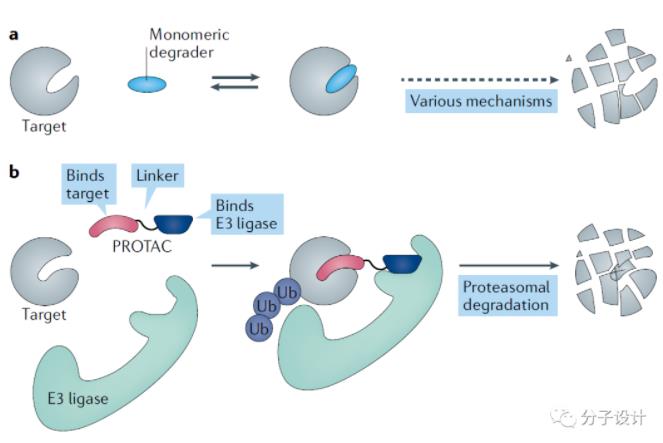
TF如结合降解剂,通过各种机制可以诱导TF降解,如雌激素受体(ER)拮抗剂氟维司琼结合LBD诱导ER降解,造成持久的抑制从而减少给药需求。蛋白降解靶向嵌合体(Proteolysis targeting chimaera, PROTAC)可人为诱导靶蛋白通过蛋白酶体途径降解,具有广泛发展空间。沙利度胺及其衍生物作为免疫调节药物(IMiD)已被批准用于多发性骨肉瘤。IMiD诱导E3泛素连接酶CRBN募集Ikaros转录因子,将其泛素化降解。最早进入临床阶段的PROTAC降解剂是分别靶向雄/雌激素受体的ARV-110和ARV-471.
4. 靶向TF的转录程序辅因子(TF collaborators)
转录辅因子(如转录激酶、表观遗传蛋白和共激活因子等)的干扰会使细胞同一转录程序产生很大差异。转录激酶(CDK7.CDK9.CDK12),组蛋白脱乙酰酶(HDACs),染色质重塑因子(BAF,CHD4)等会选择性调控超级增强子区域,都会在不同病理条件下起到转录调节作用。Gray等人开发了CDK7和CDK12的Cys反应性共价抑制剂THZ1.有效下调CDK7所调节的基因表达。类似的还有CDK9抑制剂KB-0742.调节组蛋白乙酰化的溴结构域蛋白BRD4抑制剂ABBV-744等。因此靶向表观遗传也是目前针对转录失调的有希望的途径。
未来的机遇与挑战
未来靶向TFs的药物研发主要在以下几个方向充满机遇:1)靶向TFs的隐式变构位点。通过发现TF上的变构位点进行TF的双向精准调控被认为是发现TF调节剂最有前途的方法。运用AI+实验发现变构位点为难成药的TF提供了有效的手段;2)靶向TFs的无配体结合域。成功靶向TF很大程度上依赖于明确存在的配体结合口袋,但TFs大多是内在无序蛋白(intrinsically disordered proteins,IDP),结构松散不能折叠,为此类TFs开发配体需要适合IDP表征的实验技术,而X射线和冷冻电子显微镜在解决无序区域方面表现欠佳。而核磁共振和分子动力学的结合已被证明可在原子水平上表征IDP,为识别和表征瞬态口袋及其与配体相互作用提供实践基础。3)针对TFs的靶向降解。PROTAC不依赖于配体结合口袋,分子胶水可以靶向蛋白任何区域来发挥功能,但并非所有的E3连接酶可以有效地降解特定蛋白质,且目前只有少数E3连接酶可供选择。4)靶向相分离形成的转录凝集体。相分离形成的转录凝集体影响TFs的转录活性,而相分离也影响小分子药物的分布,小分子进入细胞的情况需要深入研究,比如PROTAC分子优先分配至转录凝集体,可能难以连接凝集体之外的E3连接酶。相分离与小分子药物的相关研究,是挑战也是机遇。
参考文献:
1. Bushweller JH. Targeting transcription factors in cancer - from undruggable to reality. Nat Rev Cancer. 2019 19(11):611-624.
2. Henley MJ, Koehler AN. Advances in targeting 'undruggable' transcription factors with small molecules. Nat Rev Drug Discov. 2021 doi: 10.1038/s41573-021-00199-0.

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-08-19
2025-08-19
 17
17
 产业资讯
产业资讯
 药研网
药研网  2025-08-19
2025-08-19
 17
17

 产业资讯
产业资讯
 药视声
药视声  2025-08-19
2025-08-19
 20
20