 产业资讯
产业资讯
 药融圈
药融圈  2021-08-24
2021-08-24
 2603
2603
本周药品审评审批进展要点
近1周药审中心受理总量为229个,涉及品种168个
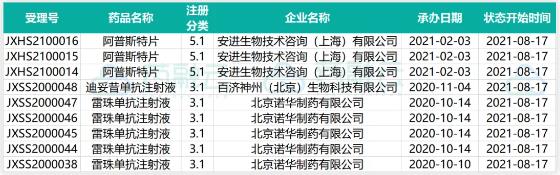
23个1类新药申请临床获CDE受理
新增11个按仿制药质量和疗效一致性评价品种申报的受理号
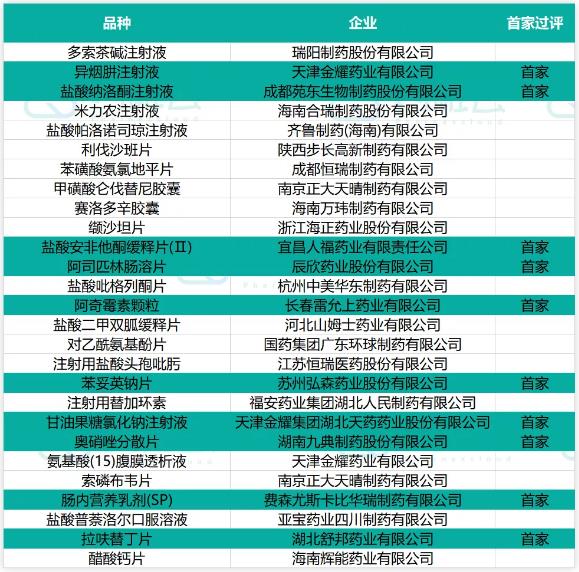
27个品种通过(含视同通过)一致性评价,10款首家过评
治疗“儿童肿瘤之王”——迪妥昔单抗注射液获批上市
回复关键词“CDE受理20210822”获取本周CDE受理品种名单
数据统计时间段为2021年8月13日-2021年8月19日,药融云将定期公示药品审评审批信息,关注我们即可定期查看。如有疏漏,欢迎指正!
2021年8月1日至8月12日期间,共有4款进口药获批上市,有20个品种通过(含视同通过)一致性评价,其中包括天津金耀药业「异烟肼注射液」、成都苑东生物制药「盐酸纳洛酮注射液」和辰欣药业「阿司匹林肠溶片」等10款首仿;百济神州的达妥昔单抗β获批上市,用于治疗神经母细胞瘤,具体信息如下:
3个品种获批生产

3个品种批准进口
百济神州的迪妥昔单抗注射液是一款单克隆抗体,可与神经母细胞瘤细胞上过度表达的一个GD2特定靶点结合。此次获批适应症为:
1)治疗≥12月龄的高危神经母细胞瘤患者,这些患者既往接受过诱导化疗且至少获得部分缓解,并且随后进行过清髓性治疗和干细胞移植治疗;
2)治疗伴或不伴有残留病灶的复发性或难治性神经母细胞瘤。
tip:迪妥昔单抗注射液是EMA唯一批准的用于治疗高危神经母细胞瘤的靶向肿瘤免疫疗法,被列入中国第一批临床急需境外新药名单。
安进的阿普米司特片最早由百时美施贵宝旗下新基研发,此次在华获批适应症为银屑病。阿普米司特是中国首个也是目前唯一一个获批用于斑块状银屑病治疗的口服磷酸二酯酶4(PDE4)抑制剂。
2014年3月,阿普米司特在美国获批上市,适应症为成人活动性银屑病关节炎,商品名为Otezla。此后又将适应症扩大至重度斑块型银屑病和贝赫切特综合征相关的口腔溃疡。2019年8月,安进宣布以134亿美元的价格通过收购获得了阿普米司特的全球权益。2020年,阿普米司特在全球的销售额高达近20亿美元,具有重大的临床需求。
过评品种信息
在审评审批阶段
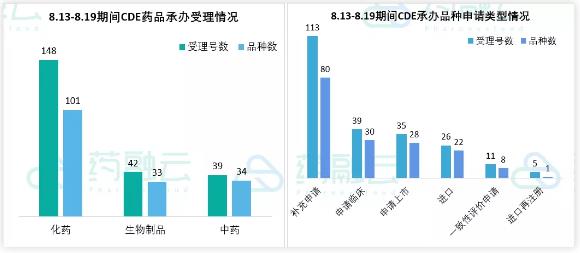
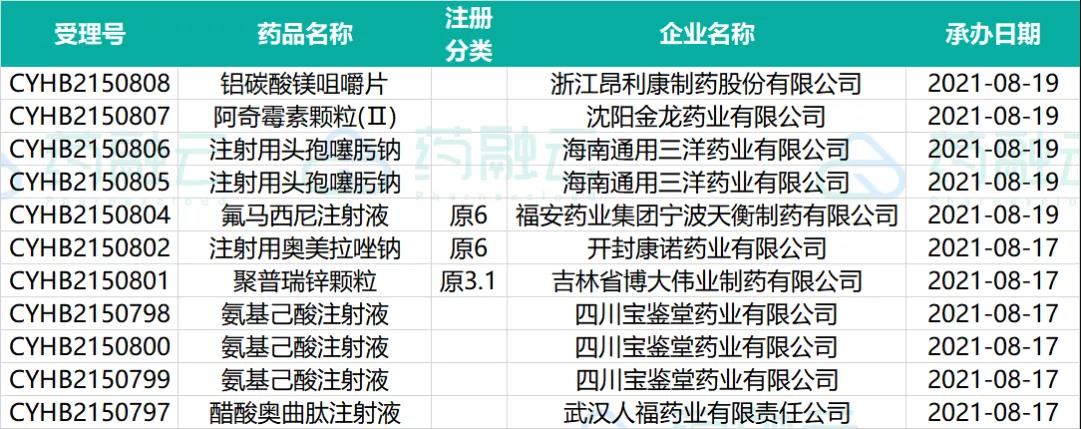
根据药融云中国药品审评数据,8月13号-8月19号期间共168个(按品种计,下同)药品获CDE承办,包括化药101个,生物制品33个,中药34个。近期CDE承办的共有30个品种申报临床,其中包括26款国产新药,另有8个品种提交一致性评价。
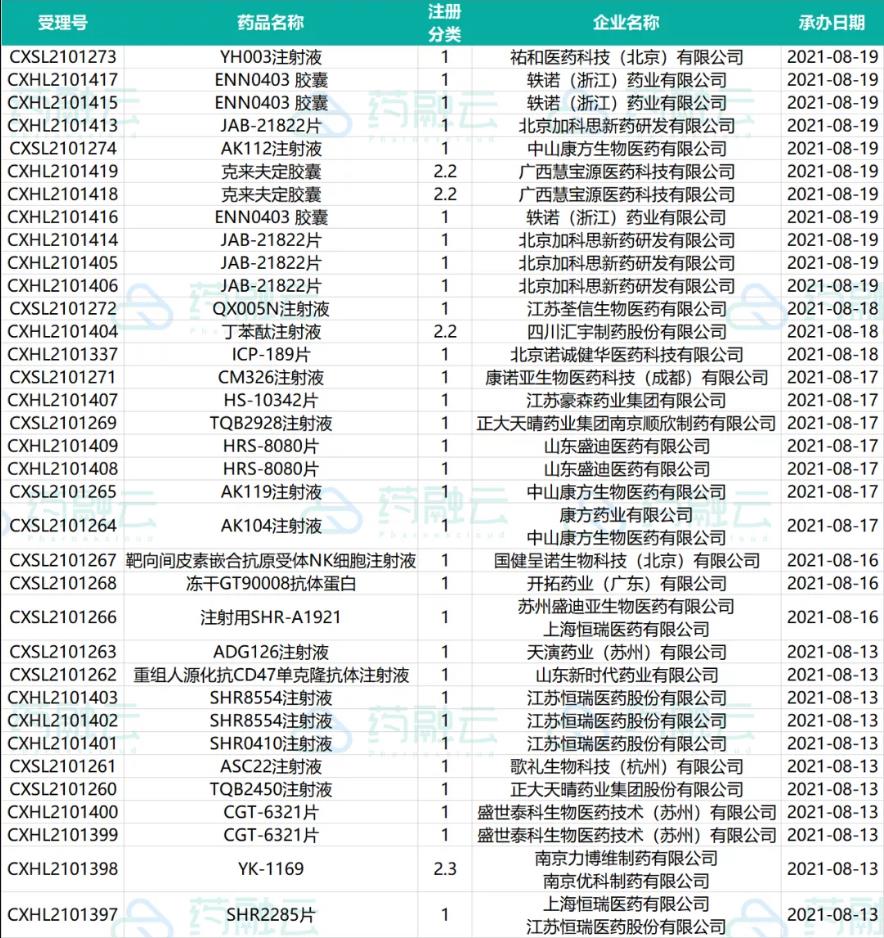
近期受理国产新药共计35个受理号,有26个品种,均为申请临床,这其中包括23款1类新药。
申请临床的新药情况
在审批阶段
近期共有38个品种(26个受理号)进入审批阶段。
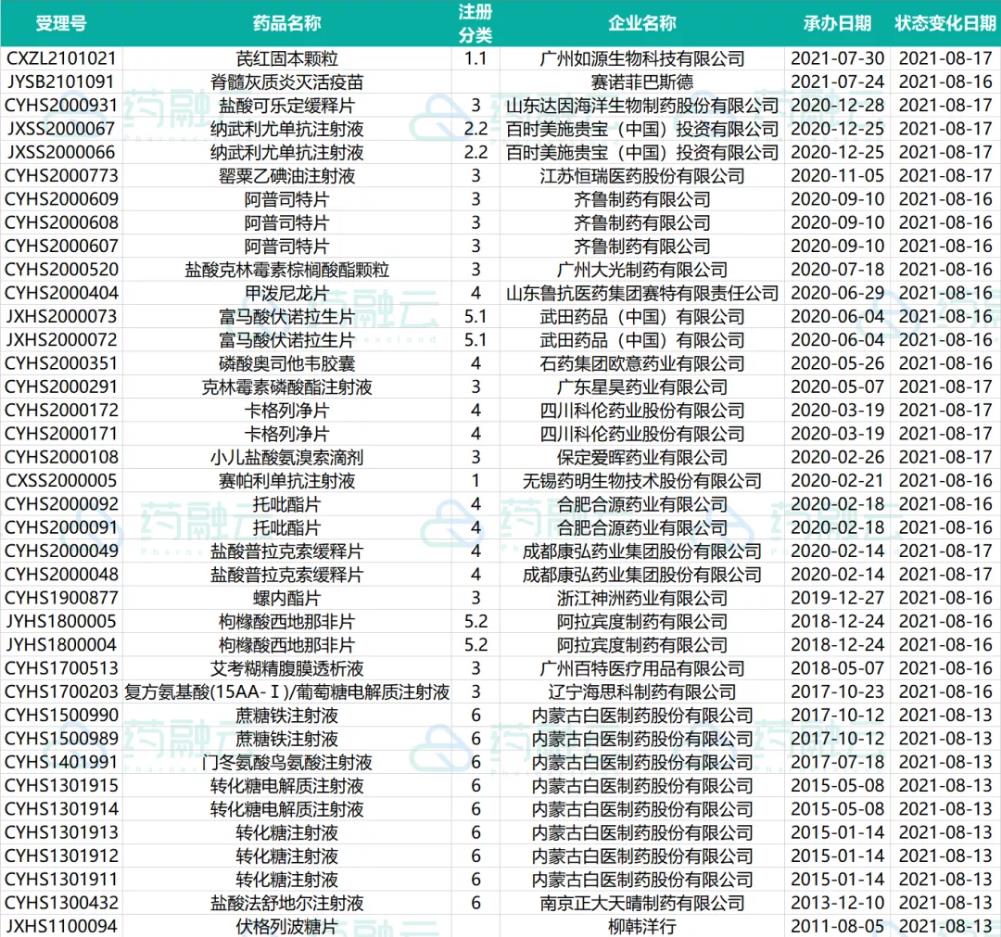
其中,赛帕利单抗(GLS-010注射液)的上市申请进入行政审批阶段,即将获批上市。本次即将获批的适应症为二线及以上复发或难治性经典型霍奇金淋巴瘤(r/rcHL)。
GLS-010注射液由誉衡生物委托药明生物研发、共同申报,是由国内研发机构完成临床试验申报的首个全人源抗PD-1单克隆抗体,具有完善的自主知识产权。
一致性评价申请
近期有11个品种提交一致性评价申请。

 产业资讯
产业资讯
 米内网
米内网  2025-11-11
2025-11-11
 14
14

 产业资讯
产业资讯
 药智网
药智网  2025-11-11
2025-11-11
 12
12

 产业资讯
产业资讯
 医麦客
医麦客  2025-11-11
2025-11-11
 16
16