 产业资讯
产业资讯
 医麦客
医麦客  2025-11-11
2025-11-11
 8
8
眼科疾病是全球致盲的主要原因之一,遗传性视网膜疾病(如视网膜色素变性、Leber 先天性黑蒙)、年龄相关性黄斑变性(AMD)等疾病,长期困扰着数亿患者。
传统治疗手段如抗血管内皮生长因子(VEGF)药物注射等,虽能暂时缓解症状,但部分需要频繁给药,患者依从性较低。近年来,创新疗法如细胞疗法、基因治疗和小核酸药物等正逐步重塑眼科治疗格局。
据行业预测,预计到 2034 年,眼科市场规模将达 1440.4 亿美元,复合年增长率达 6.4%。从 2017 年首款眼科基因疗法 Luxturna 获批,到如今超百条管线在研,基因治疗凭借其「一次治疗、长期有效」的潜力,成为眼科领域进展最快、商业化潜力最大的赛道之一。
眼科基因治疗的优势
眼科能成为基因治疗的核心适应症领域之一,主要源于眼部独特的天然优势。
首先,眼部具有免疫豁免特权,血-视网膜屏障可减少全身免疫反应,降低治疗风险。其次,眼睛结构相对封闭且体积小,局部给药(如玻璃体内或视网膜下注射)可实现精准递送,所需药量少,副作用低。此外,许多致盲性眼病由单基因突变引起,靶点明确,为基因替代治疗提供了清晰的方向。
基因治疗通过载体将遗传物质导入细胞,主要分三种类型:基因增补(如引入外源正常基因)、基因编辑(如 CRISPR-Cas9 修正突变)和 RNA 修饰(如 siRNA 敲低致病基因)。病毒载体是当前主流,其中腺相关病毒(AAV)因低致病性、高靶向性成为主力。
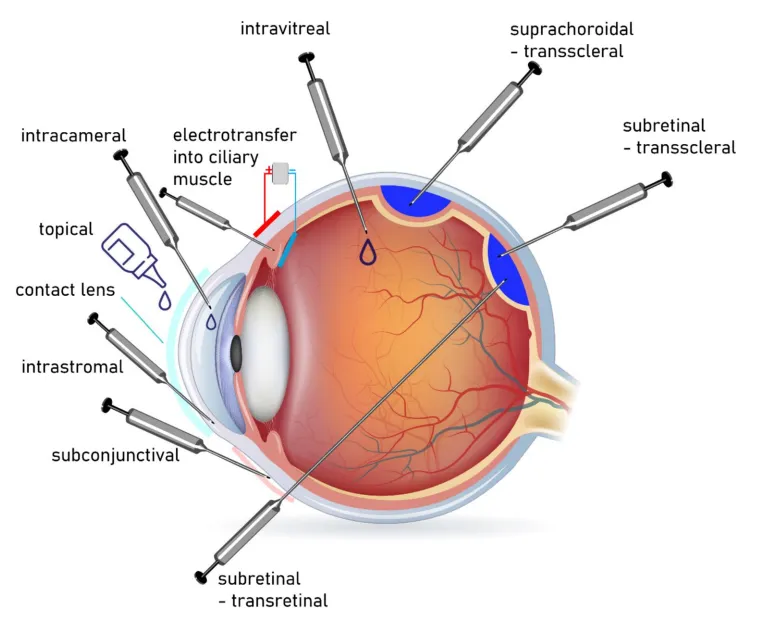
上图展示了常见给药途径,如视网膜下注射和玻璃体内注射,这些方法一定程度上平衡了效率与安全性。眼睛的光学透明性还便于非侵入性监测,如光学相干断层扫描(OCT)评估疗效。这些优势共同推动了眼科基因治疗的快速发展。
半年超 10 亿美元,
眼科基因疗法成投资风口
2025 年以来,眼科领域交易热度持续攀升,眼科基因疗法尤其成为焦点,大型药企纷纷通过收购或合作加速切入这一赛道。
根据已披露资料,下表汇总了今年眼科基因疗法的主要 4 项交易案例:
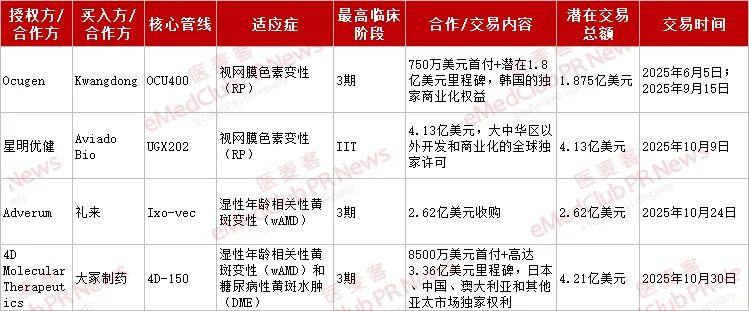
这些交易本质是对眼科基因治疗临床价值的肯定。通过合作授权、收购等多样化交易模式,不仅加速了眼科基因治疗技术落地,也为创新药物提供更广阔的市场通道。
其中,星明优健与 AviadoBio 的合作尤为引人注目。UGX202 是星明优健新一代光遗传学在研产品,以自研 AAV 病毒为载体,通过搭载宽光谱及高敏感度的创新光敏蛋白,特异性感染视网膜神经节细胞并赋予感光功能,重建中晚期感光细胞退行性疾病患者视觉通路。
其独特之处在于,作为跨基因突变的「通用型」基因疗法,其治疗效果不依赖于患者具体的致病基因突变类型,适用于多个疾病人群,包括视网膜色素变性、Stargardt 病、无脉络膜症、及晚期干性年龄相关黄斑病变等。
这种创新性使其仅处于 IIT 临床阶段即获得超 4 亿美元合作,核心在于突破了传统基因治疗对特定基因突变类型的依赖,有望解决罕见病患者因突变类型分散导致的「一病一药」研发困境,也可大幅降低临床开发成本与商业化风险。
其他几项代表性交易同样展现出一定的商业化潜力。不管是礼来收购 Adverum、Ocugen 授权 Kwangdong 还是 4D Molecular Therapeutics 与大冢制药的合作,这些交易均聚焦于临床中后期管线,反映出行业对眼科基因疗法后期临床价值的认可与期待。
管线爆发:
10+ 进入临床后期
交易热潮的背后,是全球眼科基因治疗管线的蓬勃发展。
据不完全统计,截至目前,全球有超 10 余款相关管线已进入 3 期临床,其中最快的已推进至 BLA 申请阶段。
在各类眼科基因治疗技术中,基因增补(又称基因替代)疗法是研究最广泛、进展最快的一种。该技术通过 AAV 等载体,将功能正常的基因递送至视网膜细胞,补偿因基因突变导致的功能缺失。这类疗法通常通过视网膜下注射或玻璃体内注射实现精准递送,适应症集中于特定基因突变引起的遗传性视网膜疾病,如 RPE65、RPGR、ABCA4 等基因相关疾病单基因突变导致的遗传性视网膜疾病。目前,超 10 款管线已进入 3 期临床阶段。
国内方面,朗信生物的 LX101 是首个获批 IND 的治疗 RPE65 突变相关遗传性视网膜营养不良(IRD)的基因治疗产品。该产品以 AAV2 为载体携带正常 RPE65 基因,通过转染视网膜色素上皮细胞恢复视循环功能,临床显示出良好的安全性和有效性,目前已完成临床 3 期确证性研究。
2025 年 10 月 19 日,美国眼科学会上,LX101 针对 IRD 的中国 3 期确证性临床试验随访 12 个月结果显示,受试者视功能获得具有统计学和临床意义的显著改善,达到了预设的主要终点。同时,LX101 在局部及全身均表现出良好的安全性与耐受性。
基因编辑疗法是眼科基因治疗的另一重要方向。与基因增补不同,这类技术能直接修正致病基因,为显性遗传疾病提供治疗可能。目前,国内多条管线已经进入临床转化关键期。
针对视网膜色素变性,中因科技的 ZVS203e 注射液作为国内首个进入 1/2 期临床的体内 AAV 基因编辑药物,采用第三代 CRISPR/Cas9 技术对 RHO 基因突变进行定点编辑,前期 IIT 临床试验已初步验证安全性与有效性。
在角膜营养不良领域,引正基因基因编辑疗法 GEB-101 针对 TGFBI 角膜营养不良,以自主开发的工程化蛋白递送载体(PDV,具有即时工作、无需表达翻译、快速降解特性)递送 CRISPR-Cas 核糖核蛋白(RNP),靶向 TGFBI 基因特定位置。今年 6 月全球首例针对该疾病的体内基因编辑研究性疗法临床启动,首例患者已在 IIT 研究中接受给药。
辉大基因则将 RNA 编辑技术拓展至新生血管性年龄相关性黄斑变性,作为首个进入临床阶段的 CRISPR/Cas13 RNA 编辑疗法,HG202 通过非受体结合通路利用 Cas13 编辑器部分抑制 VEGFA 的 mRNA 表达,目前在体外、体内临床前研究及首次人体试验「STGHT-I 视」中均展现良好结果。
除了上述两种技术类型外,RNA 修饰和光遗传学也为复杂眼病的治疗提供了新思路。
前者包括反义寡核苷酸(ASO)、小干扰 RNA(siRNA)等技术,通过调节 RNA 剪接或抑制基因表达来治疗疾病。例如,Sepofarsen(一种 ASO)可靶向 LCA10 患者的 CEP290 基因突变,恢复正常蛋白功能。
后者则将光敏蛋白基因导入视网膜细胞,使其具备光转导功能,替代受损的光感受器。前文提到的星明优健与 AviadoBio 的合作的核心管线 UGX202 即是一款光遗传学基因治疗产品。
值得一提的是,全球首款光遗传学基因治疗产品已提交 BLA 申请,用于治疗视网膜色素变性。若获批,将标志着该技术正式进入商业化阶段。作为创新基因治疗技术,光遗传学基因治疗跨基因突变的特性不仅能改变眼科基因治疗的格局,其在神经内科、代谢疾病等领域的应用也在持续探索,未来或将形成继单基因治疗后的新风口。
结语
整体而言,在资本、企业等多方的推动下,眼科基因治疗已经步入快速发展期。随着基因增补、基因编辑、RNA 修饰和光遗传学等多元技术路径的并行发展,以及递送系统的持续优化,这一领域有望加速从罕见病向常见病、从单基因修复向通用型治疗扩展。

 产业资讯
产业资讯
 米内网
米内网  2025-11-11
2025-11-11
 5
5

 产业资讯
产业资讯
 药智网
药智网  2025-11-11
2025-11-11
 5
5

 产业资讯
产业资讯
 医麦客
医麦客  2025-11-11
2025-11-11
 8
8