 产业资讯
产业资讯
 研发客
研发客  2022-07-01
2022-07-01
 4611
4611
药品变更,贯穿于药品研发、生产和流通全生命周期,通过科学分类设置变更通道及有区别的监管程序,既能确保控制风险,又能降低企业变更申报成本,提高研发效率。
撰文

马涛
云顶新耀/药政事务部/副总裁

曹海峰
瑞石生物医药有限公司/法规事务部/副总裁
2019年12月1日起,经第十三届全国人大常委会第十二次会议表决通过施行的修订版《药品管理法》明确规定了药品变更分类的管理制度。2020年7月1日正式实施的《药品注册管理办法》根据药物研发规律,明确了对于临床试验期间变更的管理,尊重药物研发规律,增加了对药物临床试验期间变更要求和程序,根据对受试者安全的影响程度,采取以补充申请或报告的方式进行管理;在上市许可审评期间,发生可能影响药品安全性、有效性和质量可控性的重大变更的,申请人应当撤回原注册申请,补充研究后重新申报,不涉及技术内容的变更,应当及时告知药品审评中心并提交相关证明性材料;对于上市后变更的管理,在原规定需要报补充申请和备案的基础上,增加了年度报告的途径。
对于申请人来说,大多数变更发生在临床试验期间和上市后,故下文仅对临床试验期间和上市后变更进行简单梳理。
临床期间的变更
1) 针对临床期间的变更,《药品注册管理办法》第二十九条有明确要求:药物临床试验期间,发生药物临床试验方案变更、非临床或药学变化或有新发现的,申请人应当按照规定,参照相关技术指导原则,充分评估对受试者安全的影响。申办者评估认为,不影响受试者安全的,可以直接实施,并在研发期间安全性更新报告中报告,可能增加受试者安全性风险的,采取补充申请的方式进行管理。申报途径的关注点是——安全性风险的增加,这也体现了CDE从监管角度的关注重点。
2) 针对临床试验期间的药学变更,CDE 2021年3月发布的《创新药(化学药)临床试验期间药学变更技术指导原则》,将临床期间的药学变更分为两类,重大变更和一般变更(没有中等变更)。变更的重大程度不仅取决于其对安全性和临床试验科学性的影响,还取决于研发阶段。研发阶段越早,对产品特性的理解越少,变更的可评价性就越低。因此,在临床开发早期发生的药学变更,是逐渐认识和理解药物特性的过程,需要有充分的理由和适当的评估,但不一定需要遵循严格的申报要求。在临床开发晚期,药品的各个质量属性均已确定,此时的变更需要更为谨慎。从变更评估流程看,在进行药学变更研究时,首先需明确变更的原因、变更事项和变更程度;然后结合品种特点和具体变更内容,基于风险评估思路,评估变更对药品质量、临床试验受试者安全性、临床试验结果科学性的可能影响;在此基础上判断变更为重大变更还是一般变更,并开展相应的研究工作,评估变更的可行性,并决定申报途径是补充申请还是以安全性更新报告的形式。
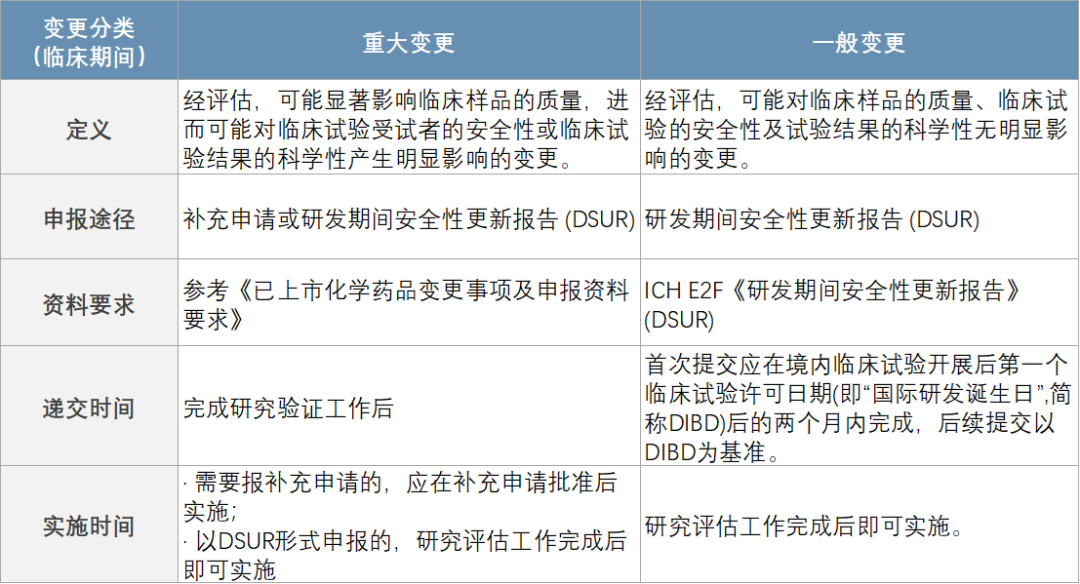
需要说明的是,在新版《药品注册管理办法》的监管下,合规性更依赖于注册申请人对产品的理解和对风险的把控。即使对该指导原则中列出的某些重大变更,如果申请人自我评估后认为不增加受试者安全性风险的,可以通过安全性更新报告递交。但需要提醒的是,申报方应该按照药品监管法律法规和GMP的有关要求,建立内部变更管理流程和控制体系。
3) 针对临床试验期间的方案变更,CDE于2022年6月23日发布了《药物临床试验期间方案变更技术指导原则》,细化了临床试验期间方案变更的分类,评估要点、变更程序和资料要求。从三个不同的维度指导申办方对试验方案变更的评估以及进行变更管理的方式。根据方案变更对临床试验受试者的安全性、试验的科学性、试验数据的可靠性可能产生影响的程度评估变更属于实质性还是非实质性;在确定为实质性变更的情况下,根据方案变更发生在确证性临床研究还是非确证性临床研究来评估与CDE进行沟通交流的必要性;根据方案变更是否显著增加受试者安全性风险来并决定申报途径是补充申请还是以安全性更新报告的形式。指导原则特别强调,对不会显著增加受试者安全风险,但可能显著影响试验科学性以及数据可靠性的实质变更,若为确证性临床试验方案的变更,虽然不需要提出补充申请,但申办者应向药审中心提出沟通交流申请。这提示申办方对于确证性临床试验方案的制定过程应有严谨的态度,方案变更前应审慎评估。
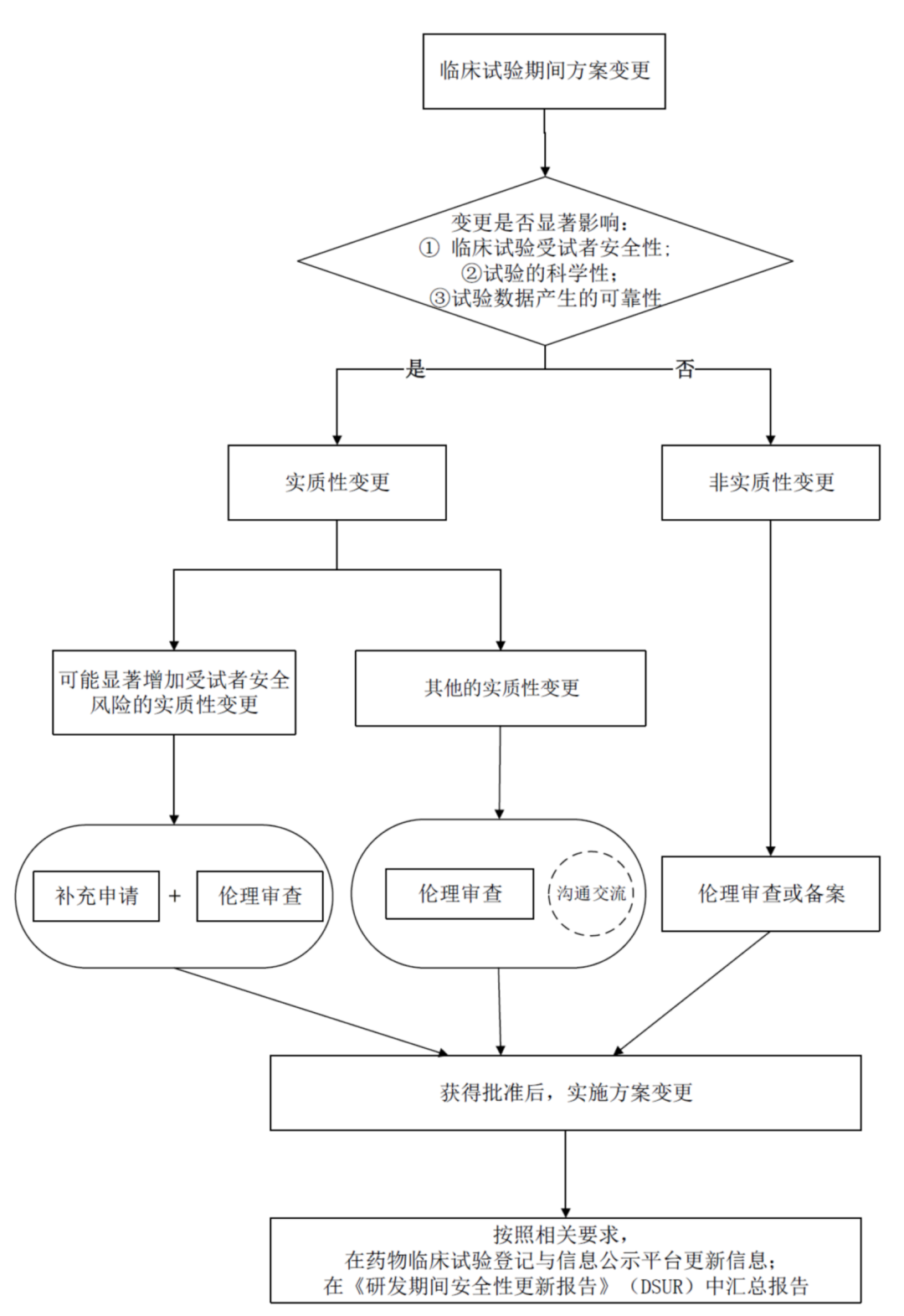
4)考虑到创新药在临床研究的阶段性,变更的多样性和复杂性,临床研究阶段的变更评估和申报途径还需要进一步完善,这些包括但不限于:
· 目前CDE仅发布了《创新药(化学药)临床试验期间药学变更技术指导原则》,建议尽快出台《临床试验期间生物制品药学研究和变更技术指导原则》,以指导生物制品研发过程中需要开展的药学变更评估和研究。
· 目前法规规定,临床试验期间可能增加受试者安全性风险的变更,需要申报补充申请。对于其它一些重大/实质变更,比如可能影响临床试验结果科学性的实质变更,申办方可以选择通过会议沟通交流方式得到CDE的评估意见。对于此类变更,如申办方自愿主动递交补充申请,希望通过审评的方式得到CDE的意见,建议CDE应予受理。
· 目前《药品注册管理办法》要求同一个产品不同适应症申报不同IND。当发生产品的药学变更,且该变更需要递交补充申请时,建议在一个IND下递交后,其它适应症的IND可以关联执行,并在年报中进行说明。
上市后变更
临床阶段的变更,申请人有较大的自主评估和选择报告路径的空间,但上市后变更,因为药品的安全有效性研究业已完成,并获准上市用于大量患者人群,因此,对药品及药品生产和质控变更进行管理时就需要更高的监管要求。建立基于风险、全程管控、持有人作为责任主体、科学严谨的和行政高效的药品上市后变更监管,是药品上市后变更科学监管的重要任务。
1)2021年1月13日,国家药监局颁布了《药品上市后变更管理办法(试行)》(以下简称《变更管理办法》),将变更从程度上分级为重大/中等/微小,对应的监管路径分别是审批/备案/报告,基于风险等级给予了中等和微小变更的实施灵活度,减轻了变更给企业带来的运营困难。
· 《变更管理办法》第四条指出,持有人是药品上市后变更管理的责任主体,应当按照药品监管法律法规和药品生产质量管理规范等有关要求,建立药品上市后变更控制体系,没有体系或体系不健全就不符合要求。
· 企业建立变更评估体系,要遵循我国药监局的指导原则和ICH指导原则制定内部变更分类原则、变更事项清单、工作程序和风险管理要求。
2)自《变更管理办法》颁布后, CDE又陆续出台了《已上市化学药品变更事项及申报资料要求》、《已上市生物制品变更事项及申报资料要求》、《已上市化学药品药学变更相关技术指导原则》、《已上市生物制品药学变更相关技术指导原则》和《已上市化学药品和生物制品临床变更技术指导原则》。变更事项的申报途径与技术指导原则定义的变更程度高低相对应,清晰明确。解决了既往法规规定与技术指导原则不匹配的问题,利于申请人和监管方对变更的管理和监管。
3)对于上市后的药学变更,变更分级的出发点是对产品的有效性、安全性和质量可控性的影响。变更技术指导原则中的变更分类有着更强的法规指导性和强制性。虽然《变更管理办法》也明确给予了持有人可根据管理和生产技术的变化,调整技术指导原则中已明确的变更分类的权利,但仍需持有人与省局或CDE沟通,获得同意后,方可调整。这些变更指导原则同时借鉴了ICH Q12《药品生命周期管理技术和监管考虑指南》,鼓励应用Q12的先进变更管理工具,在产品生命周期中以更可预测和有效的方式管理批准后的化学、制造和质量控制变化,同时要与监管机构保持沟通交流。
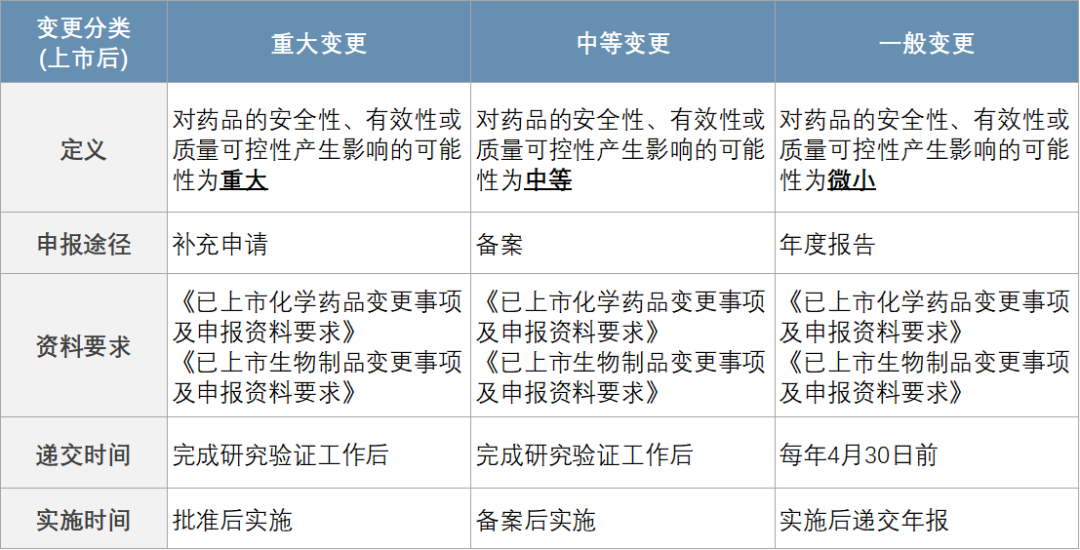
4)针对上市药品的临床变更,CDE于2021年2月份颁布了《已上市化学药品和生物制品临床变更技术指导原则》,该指导原则将临床变更分级为重大变更/中等变更/微小变更,并分别实施审批/备案/年报三级管理,变更的实施方式分别为批准后实施、备案后实施及实施后递交年报。并明确对于已上市药品增加境内未批准的新适应症、改变给药途径等,不属于变更范畴,需按照药物临床试验和上市许可申请通道进行申报和审评审批。
· 重大A类,包括已批准适应症改变适用人群/用法用量、增加同品种已批准适应症等,交补充申请获批临床、完成临床后再交补充申请获批。
· 安全性信息更新不分程度内容一律划为重大B类。
· 备案类变更主要包括参照原研/参比最新说明书变更仿制药/生物类似药说明书的安全性信息。
· 微小变更主要指药品说明书中行政管理信息的变更以及药学变更如改变注册标准编号、药品有效期时,需更新说明书的情形。
5)针对上市后变更,目前主要的挑战有:
· 变更管理类别的争议处理:建议明确对申请人申报的变更类别有异议时,需要升级处理的流程,并明确相应控制措施。为了避免如召回事件的发生,建议加强与企业间的沟通。对变更分类界定的时限,建议CDE与省局保持一致,即在20个工作日内给与答复。目前《变更管理办法(试行)》中对于境内持有人在充分研究、评估和必要的验证基础上无法确定变更管理类别的,可以与省级药品监管部门进行沟通。省级药品监管部门应当在20日内书面答复,但对境外持有人,要按照药品注册沟通交流的有关程序与CDE沟通,耗时较长。
· 由于批准/备案日期难以精确预测,且从行政完成到送达企业知悉也有时间差,现实中不可能在批准/备案后即刻实施变更,因此变更批准/备案的实施日期建议不以“生产日期”而以“放行日期”界定批准/备案的变更实施日期为宜。
· 对于除了涉及药品安全性变更之外的批准类变更的实施,《变更管理办法》给予了实施过渡期。建议明确允许过渡期内按照变更前条件组织生产的药品仍然可正常向市场供应,保证变更期间的药品的疗效、安全和质量不受影响,以保证市场的持续供应并减少企业供应链压力。
· 建议出台细则予以明确同一药品同步提出的不同注册申请事项的审评管理要求,如同时有新适应症上市申请、上市后变更申请等情形的,在什么情况下会关联审评,什么情况下会平行审评。
· 进一步完善和解释上市后变更审评和管理要求。不同变更等级下对批准证明性文件修改的通用和认可。针对微小、中等变更备案后涉及到工艺信息表、质量标准、说明书等修改的,后续再报重大变更,技术审评过程中,如何管理既往的中等、微小变更的情形,建议出台相关细则予以明确,以便进一步指导企业对已上市药品实施全生命周期的管理。
· 另外,随着新方法、新设备、新技术的涌现以及应用,希望CDE陆续出台对于一些热门的平台型组合新技术,比如ADC药物的变更技术指导原则。

 产业资讯
产业资讯
 国家医保局
国家医保局  2025-08-07
2025-08-07
 34
34
 产业资讯
产业资讯
 MedTrend医趋势
MedTrend医趋势  2025-08-07
2025-08-07
 36
36
 产业资讯
产业资讯
 E药经理人
E药经理人  2025-08-07
2025-08-07
 34
34