 产业资讯
产业资讯
 医药地理
医药地理  2022-07-08
2022-07-08
 7859
7859
真实世界研究逐渐受到监管部门和有关企业的重视。
2021年底,国家药监局联合召开2022年药品医疗器械真实世界数据应用试点工作会议,提出要深入挖掘真实世界研究对于我国药品医疗器械监管决策的支持作用,争取更多创新型临床急需产品更快获批上市,惠及更多患者。
工作会议透露了药审风向标,鼓励药企通过真实世界研究加速创新产品上市,满足更多未满足的临床需求。
药监局正式推行真实世界研究的时间并不早,但推广力度很大。继2020年1月3日发布《真实世界证据支持药物研发与审评的指导原则(试行)》,药监局陆续发布了《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》(2020年8月27日)、《真实世界数据用于医疗器械临床评价技术指导原则(试行)》(2020年11月24日),不断促进真实世界研究的规范化。
除了政策上发力,2019年,国家药监局与海南省联合启动了海南临床真实世界数据应用试点工作,探索将临床真实世界数据用于药品医疗器械产品注册和监管决策实践。依托博鳌乐城作为先行“试验田”,药械产品的真实世界研究在国内按下加速键。
6月20日,国家药监局官网公布,首个完全基于真实世界研究(Real World Study,RWS)数据申报的用于治疗慢性非感染性葡萄膜炎的新药氟轻松玻璃体植入剂已获批上市。据悉,该药2020年11月在博鳌乐城启动RWS,次年4月申报NDA。据当事企业推算,通过RWS,其商业化速度可加快1年有余,成本不到常规试验的1/4。
因此,真实世界研究将实现患者需求、监管审批和企业获益的三方共赢。目前乐城共有23个国际创新药械进入试点,随着监管方支持、企业方积极参与,未来将有更多新药借助真实世界研究加快上市,满足更多临床需求。
从“可有可无”到“不可或缺”
真实世界研究是指针对预设的临床问题,在真实世界环境下收集与研究对象健康有关的数据(真实世界数据)或基于这些数据衍生的汇总数据,通过分析,获得药物的使用情况及潜在获益-风险的临床证据(真实世界证据)的研究过程(如图1所示)。
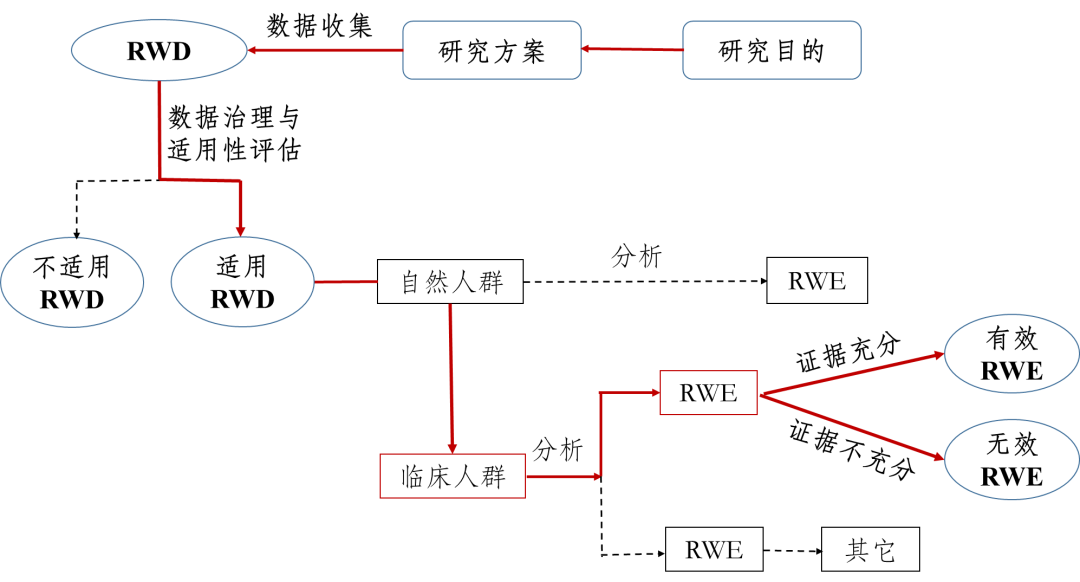
图1:支持药物监管决策的真实世界研究路径(实线所示)
与真实世界研究相对应,临床试验普遍采用的“金标准”是随机对照试验(Randomized Controlled Trial,RCT)。RCT严格控制试验入组、排除标准和其它条件,并进行随机化分组,因此能够最大限度地减少其它因素对疗效估计的影响,使得研究结论较为确定,所形成的证据可靠性较高。
不过翻开硬币的另一面,RCT也有其局限性。
一是RCT的研究结论外推于临床实际应用时面临挑战,如严苛的入排标准使得试验人群不能充分代表目标人群,所采用的标准干预与临床实践不完全一致,有限的样本量和较短的随访时间导致对罕见不良事件探测不足等;二是对于某些疾病领域,传统RCT难以实施,如某些缺乏有效治疗措施的罕见病和危及生命的重大疾病;三是传统RCT或需高昂的时间成本。
简单来说,受限于RCT高昂的成本,同时可能在实施上存在难度,临床和监管急需新的研究方法评价药物的有效性和安全性,真实世界研究应运而生。
RWS的核心优势在于能在日常临床实践中获取患者水平数据,从而使研究、监管变得便利。此外,RWS克服了高度控制的随机对照试验在代表真实世界中患者群体和治疗方案的局限性,从而使得药企通过RWS与医疗卫生利益相关方共同制定临床指南成为可能。
以博鳌乐城为试验田,RWS正在改变格局。2020年9月30日,全球创新产品普拉替尼胶囊引入乐城。该药刚在美国FDA获批后,当月便实现乐城同步落地并应用。同年10月进入乐城药品临床真实世界数据应用试点,2021年3月被国家药监局附条件批准上市,前后不到7个月。
RET融合是新近发现的肺癌驱动基因。在晚期非小细胞肺癌患者中,RET基因融合突变约占总体患者的1~2%,常见于不吸烟的年轻人群。2020年,普拉替尼胶囊通过遴选,进入海南药品临床真实世界数据应用试点。普拉替尼胶囊获批,也标志着中国第一个选择性RET抑制剂的获批上市。
中药上市新引擎
除了加快创新药品上市,《指导原则》还重点介绍了真实世界研究在中药领域的应用场景,并指出:已有人用经验中药的临床研发应根据产品的特点、基础研究的信息(如毒理试验)、临床应用情况、既往临床实践的有效数据积累等采取恰当的策略,并不局限于《指导原则》提及的策略。
应用真实世界证据支持已有人用经验中药的临床研发策略可以有多种,总体思路是将真实世界研究与随机临床试验相结合,探索临床研发的新路径。
如何理解相结合这种模式?
例如,可以探索将观察性研究(包括回顾性和前瞻性)代替常规临床研发中I期和/或II期临床试验,用于初步探索临床疗效和安全性;再通过随机对照试验或实用临床试验(PCT)进一步确证已有人用经验中药的有效性,为产品的注册上市提供支持证据。

图2:已有人用经验中药临床研发的路径之一
观察性研究是真实世界研究的一大类型,另一类为干预性研究。观察性研究不施予任何干预措施,患者的诊疗、疾病的管理、信息的收集等完全依赖于日常医疗实践。由于真实世界研究的多样性和对结果解释的不确定性,观察性研究往往对药物的安全性和有效性的评价以及监管决策提出了更高的要求。
因此《指导原则》指出,如果经过评价,存在适用的高质量真实世界数据,且通过设计良好的观察性研究形成的真实世界证据科学充分,也可与药品监管部门沟通,申请直接作为支持产品上市的依据。这为名老中医经验方、中药医疗机构制剂等已有人用经验的中药研发上市提供了一种全新路径。
除了助力已有人用经验的中药研发上市,儿童药领域更加有望获益于真实世界研究。
在实际操作中,按照传统临床试验的设计和研究方法,以儿童为受试者的试验与成人试验相比,面临更多困难与挑战。儿童临床试验常常难以开展或进展缓慢,导致药物在儿童中使用的有效性和安全性评价证据不足,从而影响儿科临床中药品的可及性和使用规范性。
真实世界研究作为新的研究方法,通过在真实医疗环境中获得质量可靠的数据,简化和避免了传统临床试验遇到的难题。目前,RWS已逐步用于支持儿童药物的研发与审评,为新药注册、拓展儿童适应症、完善儿童剂量等提供支持。
2020年9月,国家药品监督管理局发布《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》,从顶层设计出发,给予RWS在儿童药物研发实际应用中的规范和支持。
小结
RWD近年来已得到发展并在持续地发挥作用,随着医疗卫生利益相关方逐渐接受并且切实的期望RWD作为指导决策的信息的一部分,药企在证据规划、生成和传递中必须战略性地纳入RWD。通过巧妙运用并明智投资RWD,药企可以通过高效和协同效应来满足增量消费需求,同时从RWD投资中获得可观的回报,最终造福更多患者!

 产业资讯
产业资讯
 医药财经
医药财经  2025-08-08
2025-08-08
 44
44

 产业资讯
产业资讯
 药时空
药时空  2025-08-08
2025-08-08
 49
49

 产业资讯
产业资讯
 识林
识林  2025-08-08
2025-08-08
 42
42