 产业资讯
产业资讯
 Insight数据库
Insight数据库  2022-11-07
2022-11-07
 3601
3601
基于临床价值的定价
取代自由定价模式
自 1883 俾斯麦创建的世界上第一例社会医疗保障制度起,德国的医疗制度一直在不断完善,发展至今成为常年霸榜全球医疗制度排行榜的常客。
根据团结互助、社会共济的原则,德国的医保机构有义务向民众提供最好的医疗服务及药物供给。因此凭借着较为宽松的市场准入门槛和药品自由定价的规则曾使德国成为各大药企追求的流着奶和蜜的迦南之地。
然而进入 21 世纪以来,连年增长的医药支出也使得德国医疗资金越来越不堪重负,创新药物作为推高医药支出的始作俑者便进入了德国政府的击镜。
2011 年 1 月 1 日,创新药物自由定价的黄金时代落下了帷幕。取而代之的是令各大药企为之震荡的《医药产品市改革法》简称为 AMNOG (Arzneimittelmarktneuordnungsgesetz)。AMNOG 的核心是基于临床价值的定价,即只有真正有更好治疗效果的创新药物才有资格获得更好的报销价格,以此来避免效果不佳的创新药获得高额的报销价格。
效益评估与价格谈判
联动狙击创新药价格
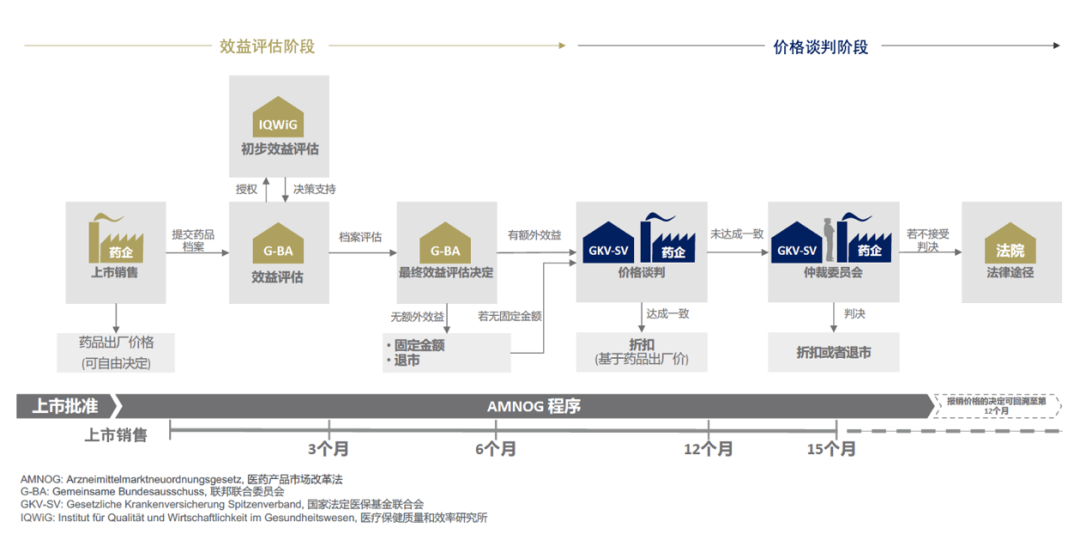
根据 AMNOG 设定的框架,自 2011 年起所有创新药物和扩展治疗领域的药物都必须经过效益评估,得出的结果将作为后续价格谈判以及药物定价的基础。
整个流程从药品在德国开始销售为起始日期,限期一年。在这一年内,药企享有药品在德国市场的自由定价权。无论定价多少,医疗保险公司都会全额进行支付。但一年期限过后,药品的价格则以谈判的报销价格为准。
来源:基于德国联邦卫生局
效益评估阶段
药企必须最迟在德国境内开始销售药品的第一天向 G-BA(Gemeinsame Bundesausschuss,联邦联合委员会)提交药品的完整档案。
接下来 G-BA 会委托 IQWiG(Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen,医疗保健质量和效率研究所)对档案进行为期三个月的评审,初次的评审结果将会向公众公开。
所有制药企业、医生及医疗联合会均有资格在评审结果发布后的一定期限内对于评审结果提交书面的意见。之后 G-BA 会召开听证会,在此,药企有机会为自己的产品进行辩护。听证会结束后,G-BA 有三个月的时间对所有收集到的信息进行整理并对药品的额外效益做出最终的判决。
关于额外效益的判决由额外效益的程度和额外效益证据的可信程度两部分组成。
额外效益的程度分为六个等级(从高到低排序):显著的额外效益、可观的额外效益、适度的额外效益、无法定量的额外效益、无额外效益和更劣的额外效益;额外效益证据的可信程度分为三个等级(从高到低排序):证据、线索和暗示。
评审的相关准则和规则细节均由 G-BA 和 IQWiG 发布在其官网中并且保持更新。效益评估的重点在于对照组药物的选择。
AMNOG 规定,对照组的药物必须为 G-BA 指定的「适当的比较疗法」。G-BA 会根据各个疾病领域的治疗指导方针和与 KOL 沟通后指定哪些药物属于「适当的比较疗法」。若药企提交的档案中的对比药物未能使用指定的「适当的比较疗法」,则会被授予「无额外效益」的评级,这将极大地影响后续药物的定价。
此外,效益评估着重评估「与患者相关的终点」。例如,是否提升了患者的生活质量,是否提高了患者的健康状况,是否缩短了患病的时间和提升了存活率等等。
价格谈判阶段
在 G-BA 公布最终判决后,药企将与 GKVde-SV(Gesetzliche Krankenversicherung Spitzenverband,国家法定医保基金联合会)以 G-BA 的判决书为依据对药品的报销价格进行为期六个月,共四至五轮的谈判。
双方的谈判队伍一般各为五人,最多可以扩展到七人,且法律已经规定了每轮的谈判内容和流程。在四至五轮的谈判期间,会主要针对以下主题进行讨论:额外效益的程度和可靠性,药品预计的销售量和销售额,药企对于该产品在其他参考国家的药品出厂价格,其余相关药物的价格等。
如果双方在六个月内无法达成共识,则最终的报销价格由仲裁机构进行裁决,若对仲裁结果仍有疑问则可以通过法律途径进行上诉。
值得注意的是,由药企自由设定的价格有效期仅截止到第 12 个月,若在谈判期间双方未达成一致而选择进入仲裁等阶段,那么最终确定的价格则可以回溯至第 13 个月起效。
若药品最终获得「无额外效益」或更低的额外效益类别时,则该药品能够获得的最高报销金额不得高于最经济性的「适当的比较疗法」。只有具有额外效益的药品才能获得高于最经济的「适当的比较疗法」的报销金额。
这意味着价格谈判的锚点是最经济的「适当的比较疗法」而非药企自己的定价。因此,「适当的比较疗法」的确定显得尤为重要。
如果在某个疾病领域中非常便宜的抗生素被选为一个生物创新药的适当的比较疗法的话,那么对于该生物创新药来说,其最终的报销金额可能是非常残酷的。
值得关注的是,AMNOG 授予了罕见病药物一个有条件的特权:
若药品获得了 EMA 颁发的罕见病药物认证,那么该药物将自动被视为具有额外效益,不需要经过审核可以与 GKV-SV 直接进行医保报销价格的谈判。
但当罕见病药物的年销售额超过五千万欧元时,则该药物不再享有特权,并且药企必须在三个月内向 G-BA 提交完整的药物档案进行审核。
AMNOG 极大提高了
创新药物准入德国市场的门槛
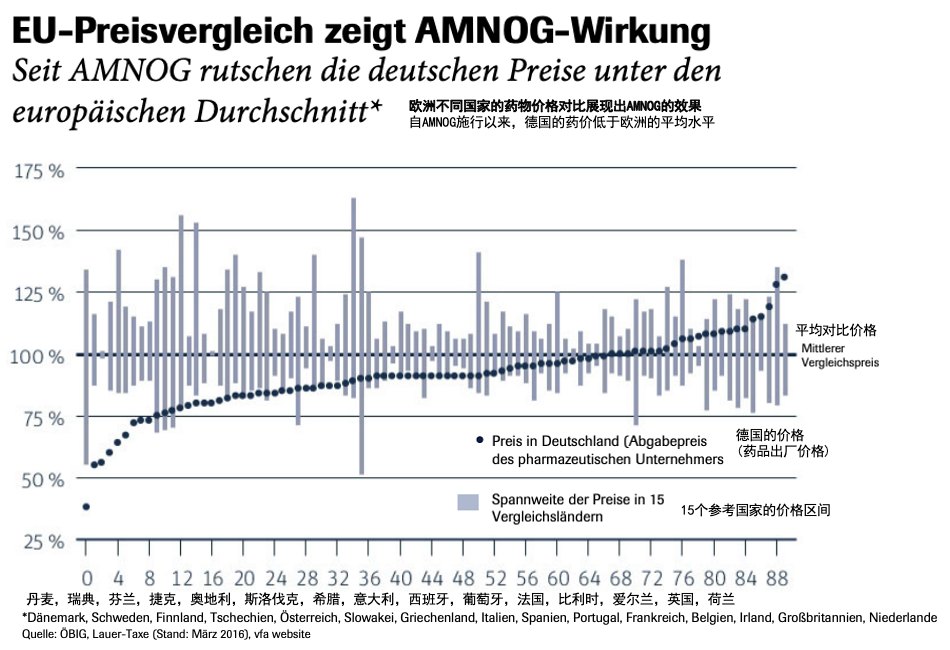
来源:研究型制药企业协会 (vfa: Verband Forschender Arzneimittelhersteller)
上图为 vfa 于 2016 年公布的 AMNOG 对药价的影响。从图中可以明显地看出 AMNOG 实施后德国大部分产品的药价明显低于欧洲其余 15 个国家平均价格。
AMNOG 的实施确实极大的降低了创新药物的价格,但同时也引发德国医疗行业从业者的担忧,因为很多从业者认为 AMNOG 极大地提高了创新药物准入德国的门槛:
从商业的角度来看,药物在德国的定价会被欧洲其余的国家参考,如果由于未获得额外效益而使得谈判价格过低则会影响药品在其他国家的定价,因此导致很多创新药物推迟或者撤出德国市场,这极大损害了德国民众享受先进医疗进步的可能性。
从审核规则的角度来看,很多评审标准和细则都存在争议,最终给出的结论可能无法很好地诠释创新药物带来的益处,而且药企需要提前至少一年的时间和大量的人力物力来准备效益评审所需的档案和资料,这都加剧了创新药进入德国的难度。
虽然 AMNOG 极大提高了德国市场准入的难度,但这并不意味着无法成功进入德国市场。想要在德国市场获得成功,理解吃透 AMNOG 评审的规则、精心准备药物额外效益评估的档案、与相关部门取得并保持良好的沟通和取得 KOL 的帮助是关键。

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-06-18
2025-06-18
 38
38

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-06-18
2025-06-18
 46
46

 产业资讯
产业资讯
 动脉网
动脉网  2025-06-18
2025-06-18
 43
43