 产业资讯
产业资讯
 同写意
同写意  2022-12-01
2022-12-01
 2342
2342
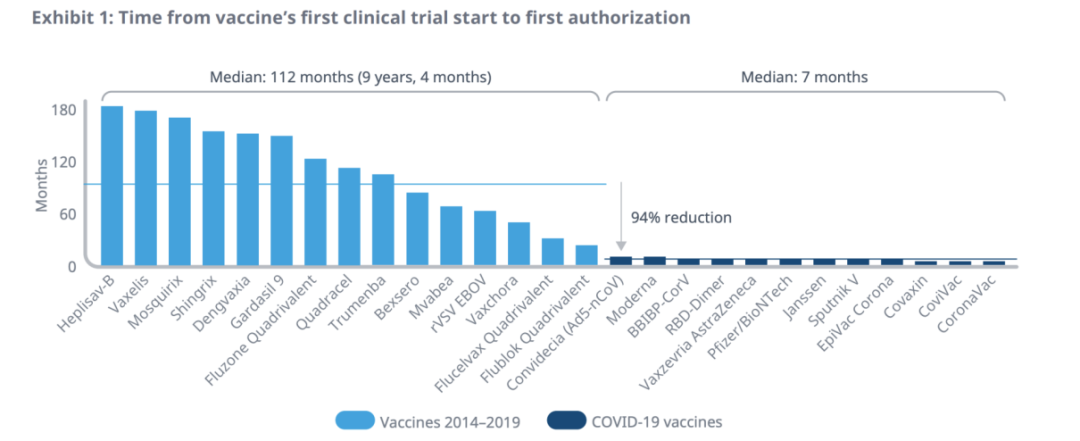
截至2022年4月,新冠病毒已经导致全球超5亿人感染和620万人死亡,随之而来的是对疫苗的强烈需求。在各方努力之下,新冠疫苗开发的速度前所未有——从临床开发到上市仅用时7个月,与历史疫苗开发的中位数时间相比,时间缩短了94%。
这种“加速”离不开CRO的深度参与。IQVIA从CRO的角度出发,探讨了新冠疫情之下,临床试验效率提升背后的制药模式的变化。而这种剧烈变化,究竟会为行业带来何种新的可能性?在疫情后的其他管线开发中,又有哪些因素将会持续发挥作用?
时势造英雄
新冠疫苗研发飞速的“主要动力源”,即是运营环境的深刻改变。根据IQVIA统计,在新冠疫情期间,有超过200亿美元的包括政府投资在内的资金流入,这从根本上扭转了过往决定资源流向的风险-收益信条,也为重塑临床开发模式创造了新机会。
1公私合作
驱动新冠疫苗临床研究转化的基本因素之一,则是对抗疫情时发生的金融去风险。IQVIA指出,公私机构分别提供了大约190亿和15亿美元的临床开发资金。此外,双方还推动实验室试剂等关键物料的获取,组建和管理跨项目合作的现场网络,并解决许可证、海关等移动工厂或会面临的问题。
2监管机构响应
在全球范围内,监管机构对新冠疫苗的临床开发的支持,表现出极大的灵活性,包括精简远程监控指导,增强国际合作,使用数字工具缓解监管压力等。通过迅速且大量的沟通、指导、协调,监管部门加速审评审批过程。
3参与试验的兴趣
来自临床医生和志愿者的热情支持,构成了新冠疫苗研发的独特背景。IQVIA表示,在2019年到2020年,疫苗注册人数迅速增加。在感染病研究所等机构全力支持下,患者招募进展顺利——Pfizer/BioNTech、Moderna和J&J的三大基石疫苗试验,在3个月时间,共招募到了13万名受试者。
4已有技术铺垫
SARS-Cov和MERS-Cov疫苗平台的经验、测序技术的普及、mRNA疫苗平台、载体等技术的成熟,以及新冠病毒的测序共享,使得能在符合监管规定前提下,实现近乎实时的疫苗开发。IQVIA表示,研究人员在数周内就完成了从病毒鉴定到临床前实验,3个月内将进度推至临床试验阶段。
这些环境促成因素影响深远。简而言之,它们作用交织,共同降低了药物创新和资源投入的风险,并加速制药过程中的多个环节,这对疫苗的交付至关重要。
速度、速度!
为更好地理解时间节省,以及哪些改变可以在未来的药物开发中重现,IQVIA选择了三个规模相似(多于3万人参与)、公私合作共同开发的、有关新冠疫苗的关键临床II期/III期试验,并对其开发时间轴进行分析。
IQVIA得出结论:在去风险化背景下,同时推进临床与生产,是新冠疫苗快速上市的主要原因。由图表可以看出,在I期试验结束之际,新冠疫苗的II/III期试验几乎立刻启动。一旦收集到足够的安全性和有效性数据,立刻申请EUA(紧急使用授权)。
在这一过程中,来自药企、监管机构、患者、试验人员等方面的积极响应,压缩了介于决策和试验开展之间的“空白时间”。IQVIA在报告中指出,上述原因加速了近一半新冠疫苗的开发过程。
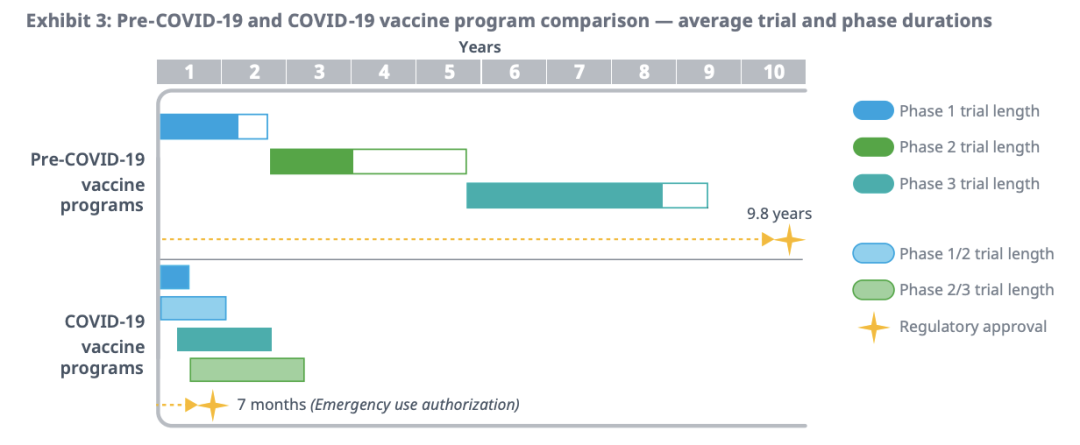
此外,IQVIA还对单个试验的进度进行分析,详细到试验执行的每个阶段——合同签订、研究启动、入组、治疗以及数据库的锁定和分析等。结果发现,相比之前的疫苗研发,新冠疫苗的开发时间大约缩短了26个月,即提升70%的开发速度。
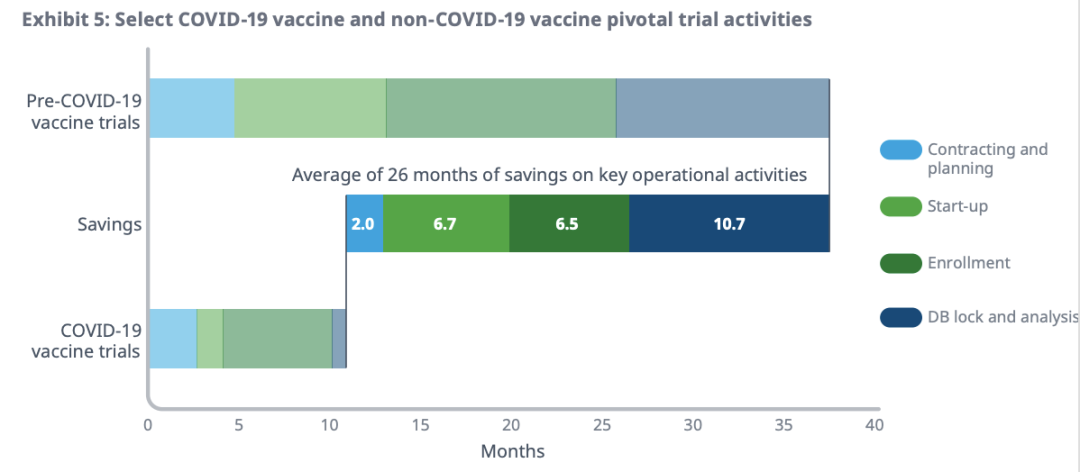
1合同签订环节:节省了2月,速度提高44%
药企和CRO的合同开始于招标书(RFP),既往RFP平均花费4.5月。新冠疫苗在该环节的效率提升,主要可归功于简短的招标和中标过程,包括不限于使用精简材料,缩减投标人数等。此外,疫情来势汹汹,叠加公私机构的鼎力支持,双重推动之下,药企决策重点偏向消除临床风险而非财务风险。
2研究启动:节省了6.7个月,速度提高了83%
临床研究的启动,需要诸多紧密协调的工作,贯穿于研究机构的选择、方案制定、招募患者以及监管协调等环节。CRO利用其资源与经验,可有效加速这一过程。此外,合作协议以及CRF(病例报告表)的简化、关键测量和标准的共享,也帮助减少试验设计方面的重复工作。
3患者入组:节省了6.5个月的时间,速度提高52%
过去十年,超1万名规模的的疫苗试验,入组平均耗时12.5个月。新冠疫苗试验的速度提升在于流程创新与精简,以及资源重点投入。高传染性的病毒,提供了一个庞大的患者群,使得患者招募与入组顺利。
4数据库的锁定和分析:节省10.7个月的时间,提高了95%的速度
数据库锁定可以说是研究的重要里程碑,表明此时数据库中的数据完整、可靠,可用于统计分析。这一过程速度的飞跃般提升,IQVIA认为是资源集中和流程优化的结果——确保持续的实时数据处理和准备,这对紧急使用授权颇为重要。
至于治疗和随访,由于新冠疫苗设计以及病毒演化,与既往试验基准不同,所以IQVIA没有比较两者时间差距。但在疫情冲击下,面对地域封锁、现场员工短缺等情况,远程监控、现场支持等数字创新方法无疑发挥了重要作用。
创新与投资的步伐
对于上述加速,IQVIA也对背后的更深层次原因进行挖掘,认为其主要受业务行为、组织调整和模型改变等因素驱动。
业务行为方面,主要表现为具体的流程创新、精简和资源利用的转变。这些变化贯穿于整个试验,直观地引起试验效率的提升。
组织调整方面,比如实施重点组织结构,优化领导层参与、申办者和CRO关系、团队工作结构以及质量和流程管理机制,以便更好的地支持运营行为。

模型驱动是指,在新冠疫情背景下,基本的行为与商业模式发生了根本性的转变,在伙伴合作、决策过程、流程创新和资源优化等因素影响下,加速试验进程。其中,后两者则是最大的效率贡献者,分别占到了35%和31%的份额。
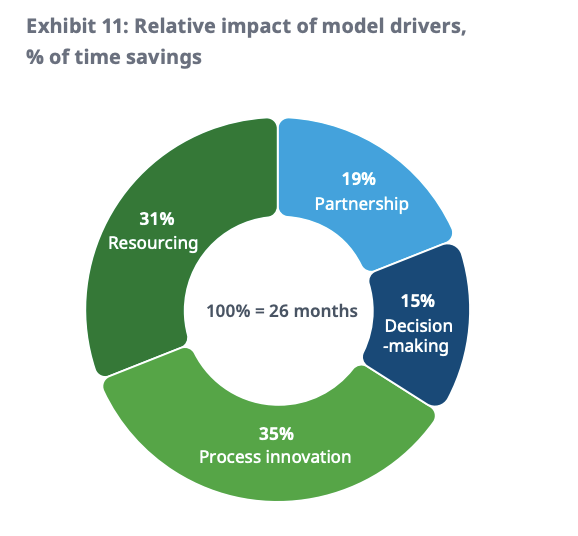
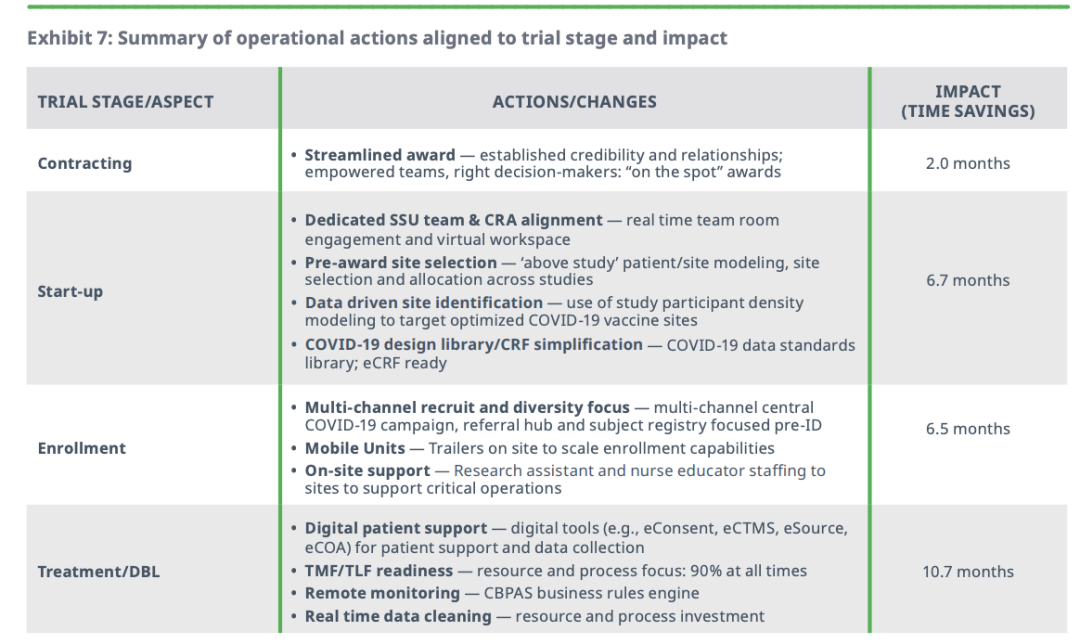
1流程创新
对新冠疫苗试验有明显影响的创新措施,有多渠道招募、数字研究受试者、现场支持技术、远程监测工具和方法,以及实时数据清理和管理等。值得注意的是,这些创新早在新冠疫情之前就开始“小试牛刀”,但尚未真正形成规模,疫情催动之下,才有了“大施拳脚”的机会。
2资源投资
资金等系统性资源通过OWS、CEPI和其他机制流向试验团队。申请方和CRO对特定流程步骤中的人员配置的投资,帮助提高临床试验速度。资源投资对于扩大和成功实施上述大多数流程创新也至关重要。
投资回报率分析也凸显出一系列高效的变化,暗示在疫苗试验之外,上述创新转变因素具有推动其他产品价值的潜力。另外,更加密集的投资,也有力催动创新落地的实践,当然这方面,也纳入了大规模或者时效性试验中更为强调的速度指标的考虑。
带向未来的经验
比较新冠前后疫苗试验的资源利用情况,IQVIA发现,对项目、试验机构和研究参与者层面进行投资,的确可以加快临床试验节奏。
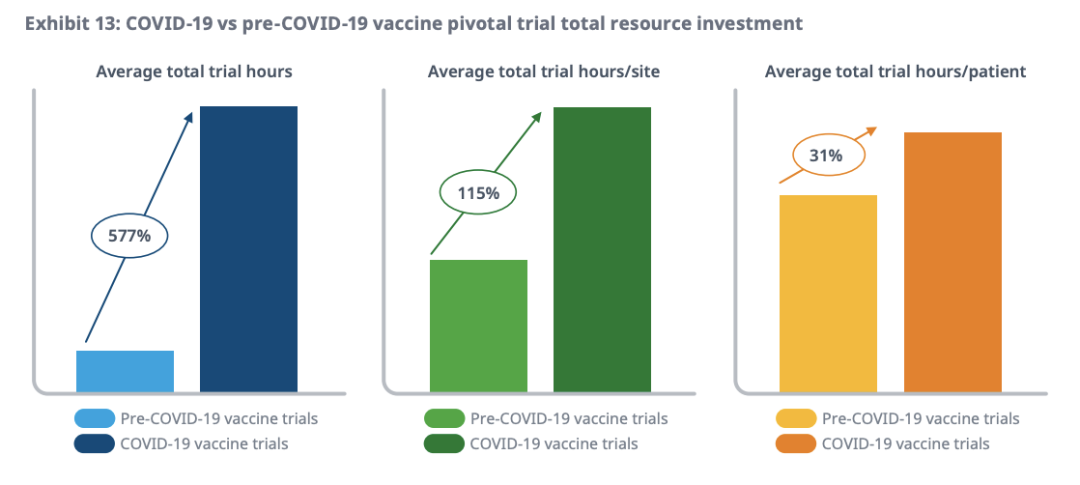
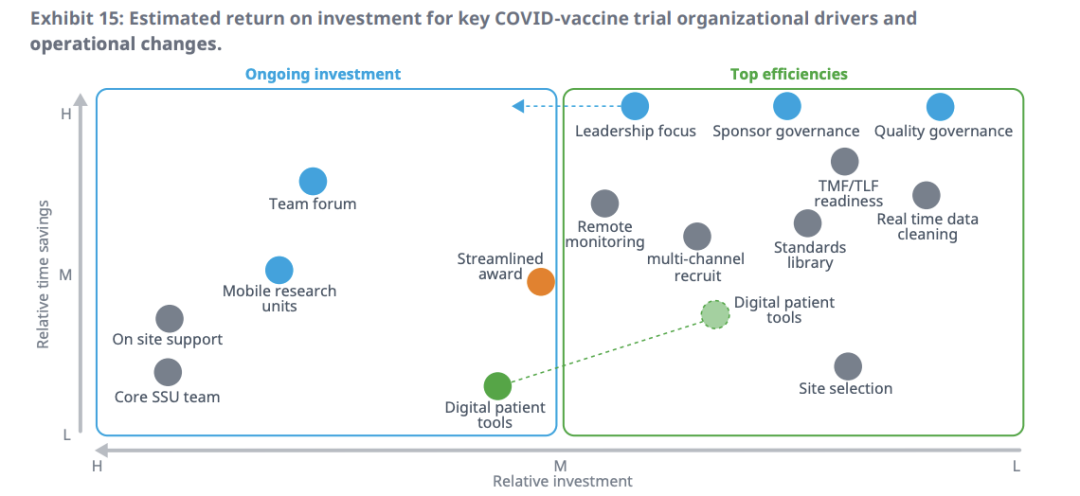
IQVIA将资源投资与相对的效率回报联系起来,对新冠疫苗开发的投资回报进行定性,并突出了两个投资类别:最高效率和持续投资。
最高效率是指那些具有较高时间效益但投资较低的工作,比如数据管理、远程监控和多渠道招募等创新投资,这些投资在疫情发生期间迅速扩大规模以提高效率。此外,它还包括对核心领导层、伙伴关系和质量流程的关键组织资源配置。
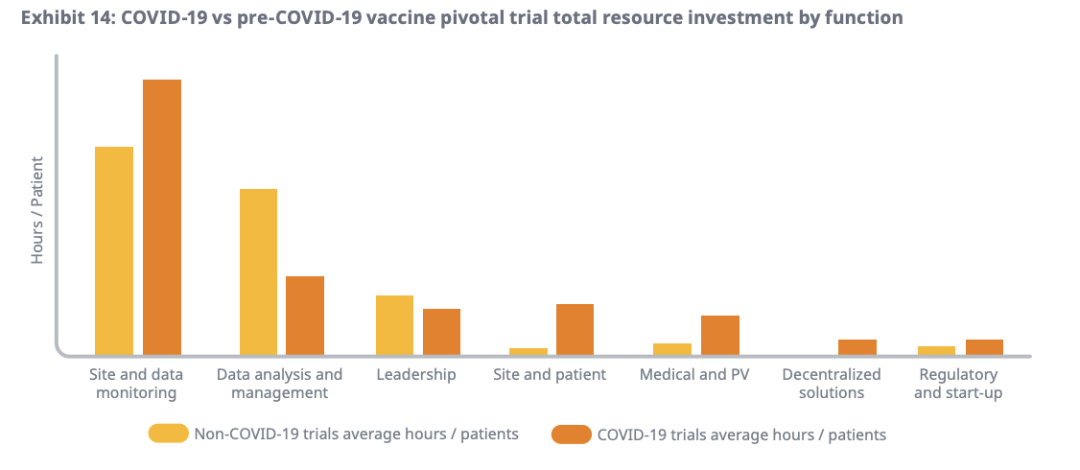
持续的投资,则是指与资源强度密切相关的流程投资。比如数字研究受试者等方面的创新,在新冠疫苗试验中发挥关键作用,但仍需要进一步的行业投资以实现规模化。另外,现场支持和移动研究单位等解决方案,通过增加资源强度来获得时间上的优势,适合大规模的招募和受试者处理。
高投资回报率的改进有望对其他管线造成深远影响。但仍然需要确认,关键的创新是否能继续成熟,外部促进因素是否持续存在。
新冠疫苗的经验提醒我们,当速度成为“燃眉之急”时,实际上有多种合作方式可供选择。通过对时间、成本和风险等因素的权衡,CRO和申办者能对试验和项目投资做出联合决策。在这一过程中,CRO具有明显的加速开发时间的潜力。
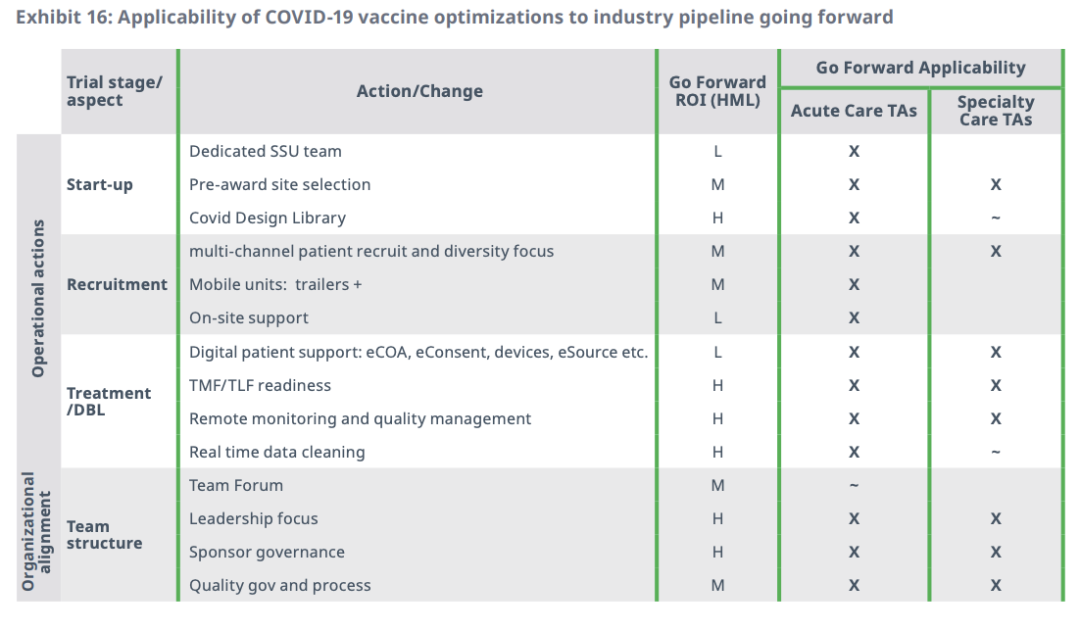
此外,目前创新曲线上,仍有一些方案,需要CRO和制药业对其投资进行大规模实施。本质上,新冠疫情为行业提供了一个重要的“概念证明”——对显现出的创新手段进行持续投资,以便之后大规模实施,将其高效应用到更广泛的领域。
IQVIA在报告的最后指出,随着投资的持续进行,这些创新将逐渐成熟,从持续的投资类别转化为最高效率。
原文参考:
Lessons Learned from COVID-19 Vaccine Trials;IQVIA

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-05-23
2025-05-23
 38
38

 产业资讯
产业资讯
 科睿唯安生命科学与制药
科睿唯安生命科学与制药  2025-05-23
2025-05-23
 33
33

 产业资讯
产业资讯
 空之客
空之客  2025-05-23
2025-05-23
 35
35