 产业资讯
产业资讯
 一度医药
一度医药  2023-05-19
2023-05-19
 2285
2285
继信达生物的Tyvyt(信迪利单抗)被FDA拒绝批准并引发礼来“退货”后,另一款国产PD-1抑制剂正以全新策略谋求FDA的批准。
恒瑞医药PD-1抑制剂卡瑞利珠单抗(艾瑞卡)联合阿帕替尼(艾坦)——“双艾”组合对标罗氏联合疗法直指肝癌一线治疗!
“双艾”组合瞄准大适应症
5月17,Elevar Therapeutics表示,该公司已向FDA提交了一份上市申请,将江苏恒瑞制药的PD-1抑制剂卡瑞利珠单抗(camrelizumab)和VEGFR抑制剂阿帕替尼(rivoceranib)联合用于治疗新诊断的不可切除肝癌。

和之前国产PD-1选择小适应症切入不同,恒瑞和Elevar直指大适应症的一线治疗!
目前罗氏的PD-L1/VEGF组合Tecentriq和Avastin是FDA批准的唯一一种用于一线肝癌的免疫疗法。如果“双艾”组合获得批准,将成为继罗氏之后获FDA批准用于肝癌的一线免疫疗法的第二款组合产品,同时也为国产PD-1出海开辟了一条新路。
“双艾”获批胜算几何?
恒瑞“双艾”组合在国内早已如雷贯耳。
今年1月,“双艾”组合刚获国家药监局批准用于晚期肝细胞癌一线治疗,成为中国首个获批用于治疗晚期肝细胞癌的PD-1抑制剂与小分子抗血管生成药物组合,获批的适应症具体为不可切除或转移性肝细胞癌患者的一线治疗。
反观FDA这边,早前出海的先驱们探索出的监管侧重点主要包括两项:一是临床入组人群的广泛性,应该尽可能涵盖美国族裔;二是产品疗效,应该不逊色于标准疗法。
Elevar本次提交上市主要基于3期CARES 310研究的数据。该研究是一项评估“双艾”组合对比索拉非尼治疗既往未接受过系统治疗的不可切除或转移性肝细胞癌患者有效性和安全性的随机对照、开放性、国际多中心III期临床研究,由南京金陵医院肿瘤中心秦叔逵教授担任全球主要研究者,全球13个国家和地区的95家中心共同参与。
入组人群方面,虽是一项国际多中心研究,但CARES 310受试者中亚洲患者的比例很高。Elevar首席医疗官Jan Van Tornout表示,由于新冠疫情的影响,该研究纳入非亚裔患者比例为17.3%,低于FDA要求的20%。
疗效方面,3期结果显示,“双艾”对比索拉非尼作为一线治疗可以显著延长晚期肝细胞癌患者的无进展生存期(PFS)和总生存期(OS)。其中位无进展生存期(mPFS)为5.6个月,中位总生存期(mOS)为22.1个月(索拉非尼组为15.2个月),将疾病进展或死亡风险降低 48.0%,患者死亡风险降低38%。
此外,“双艾”联合治疗方案的客观缓解率(ORR)为25.4%、疾病控制率(DCR)为78.3%(基于RECIST 1.1标准),且安全性可控,耐受性良好。
值得注意的是,目前的国际指南支持使用免疫治疗联合作为晚期HCC的一线治疗,因为这些联合疗法已被证明优于旧的标准疗法索拉非尼,如FDA批准的Tecentriq和Avastin,以及欧洲批准的durvalumab和tremelimumab双免疫联合疗法。
目前,还缺乏不同组合之间头对头的正面比较。因此,尽管“双艾”组合实现了目前晚期肝癌一线治疗最长OS获益(22.1个月),但最理想的状态还是和罗氏的TA组合头对头证明非劣效。
此外,此次提交的上市申请文件还面临其它挑战。比如,对于任何联合疗法,FDA都要求提供其中每个成分有意义的证明。但是卡瑞利珠单抗和阿帕替尼均未在美国上市,只在中国晚期肝癌患者中有单药治疗数据,因此很难用FDA信服的方式来证明两种药物各自的功效。
好消息是,“双艾”组合一线治疗不可切除或转移性肝细胞癌适应症此前获得美国FDA孤儿药资格认定,有望在后续研发及商业化开展等方面享受政策支持。
国产PD-1破冰之旅
国产PD-1“四小龙”中,除信迪利单抗遭遇重挫之外,另外两款特瑞普利单抗(君实和coherus)和替雷利珠单抗(百济和诺华)都从小适应证入手,积极探寻出海通道。目前,特瑞普利单抗和替雷利珠单抗上市申请已获英国和欧盟监管部门受理。对于全球最大的创新药市场美国,两款PD-1仍在等待FDA不断延期的决定。
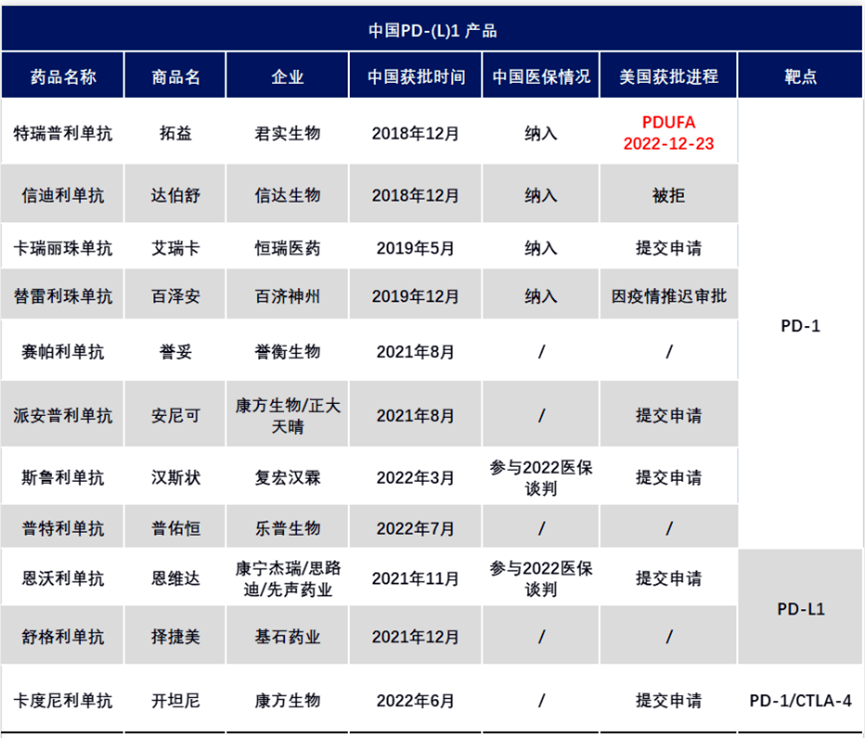
图源:医趋势
其中,君实特瑞普利单抗是首个向FDA递交上市申请的国产PD-1抗体药物。2021年10月,FDA受理君实生物特瑞普利单抗单药以及联合疗法用于鼻咽癌的生物制品许可申请(BLA)。此后审评决议一再推迟,双方反复沟通。今年2月,君实和Coherus宣布Toripalimab联合吉西他滨和顺铂作为复发性或转移性鼻咽癌一线治疗的关键临床3期JUPITER-02获得积极结果,有望更快推进Toripalimab获批。
百济的替雷利珠单抗选择从后线治疗食管鳞状细胞癌切入,但去年7月,FDA宣布因为新冠疫情造成的旅行限制而推迟审评决定。百济和诺华对替雷利珠单抗充满信心:百济着手在新泽西建厂实现就近制造;诺华计划扩大替雷利珠单抗在美国的适应症申请,新增适应症包括二线非小细胞肺癌和鼻咽癌。
此外,康方生物、复宏汉霖、康宁杰瑞等药企的产品也已在美提交申请。国产PD-1出海主流市场仍然等待破冰。
参考信息:
1.Regulatory tracker: Another China-made PD-1 starts FDA journey as Elevar, Hengrui target big cancer type(fiercepharma)
2.猎药人俱乐部:临床证据为王,国产PD-1出海 “破局”有望!君实生物PD-1单抗在美获关键3期结果

 产业资讯
产业资讯
 米内网
米内网  2025-11-11
2025-11-11
 14
14

 产业资讯
产业资讯
 药智网
药智网  2025-11-11
2025-11-11
 12
12

 产业资讯
产业资讯
 医麦客
医麦客  2025-11-11
2025-11-11
 16
16