 会员动态
会员动态
 Insight数据库
Insight数据库  2023-05-19
2023-05-19
 2963
2963
5 月 17 日,Elevar Therapeutics 宣布,已向 FDA 递交 PD-1 卡瑞利珠单抗联合阿帕替尼一线治疗肝细胞癌的新药上市申请(BLA)。
据 Insight 数据库显示,Elevar Therapeutics 是阿帕替尼的海外权益持有者,与恒瑞 PD-1 卡瑞利珠单抗的联用临床合作在 2018 年 10 月达成。根据合作协议,恒瑞负责临床试验的管理,联用组合的境外临床费用双方均摊;Elevar 保留阿帕替尼的海外权益,恒瑞则拥有卡瑞利珠单抗的权益。

截图来自:Elevar Therapeutics 官网
这是在信达、君实、百济、天晴之后,第 5 家正式向 FDA 提交上市申请的国产 PD-1。而第 6 家也已经箭在弦上,复宏汉霖头对头罗氏 T 药的小细胞肺癌美国桥接临床试验正在进行中,拟报上市。
疫情过后,FDA 的海外现场检查已经恢复,进展较快的君实和百济都有望在今年得到审评结论,这场 PD-1 们向美国市场发起的商业化争夺战已经即将决出冠军。尽管国内 PD-1 已经一改前两年烈火烹油之势屡屡遇冷,但首次「破零」仍会是令人振奋的里程碑事件。
同时,在超过两年的出海征程中,国内药企也不再只盯美国市场,开始在欧洲、东南亚等全球市场广泛布局、多点开花,在内卷中诞生的创新成果即将在海外兑现商业和临床价值。
申报策略各异,国产 PD-1 们胜算几何?
国产 PD-1 们的美国申报审评恰逢 FDA 对加速批准政策和临床价值的重新审视和调整,最终也导致了先行者信达生物的首战失利。不过这宝贵一课让国内企业对海外监管机构注册和审评的认知也愈发成熟和清晰。
从申报适应症来看,目前活跃中的出海 PD-1 单抗选取的切入点都各不相同,一方面在癌种选择上侧重亚洲高发癌种,发病率差异或可为其临床证据积累和注册临床入组人种比例提供依据;另一方面则布局总体发病率居高的癌种,以获取更大的回报。
国产 PD-1 美国申报情况概览

数据来自 Insight 数据库网页版,人工整理如有纰漏还请指出
君实、正大天晴主攻鼻咽癌,这个适应症患者群体主要是亚洲人,在美国属于罕见癌种,在监管审批上有优势。百济选择食管鳞癌,恒瑞则选择肝细胞癌,这两个癌种同样是亚洲发病率高于欧美的癌种,不过在全球范围内也位列 TOP10 癌症之列。复宏汉霖选择小细胞肺癌为突破口,则主要基于临床数据上的独特优势。
国产 PD-1 们胜算几何?我们来一起看看注册临床依据。由于 FDA 对信达提出的疑问主要基于终点设置、入组人群和对照药,Insight 以此维度做了整理:
1、卡瑞利珠单抗
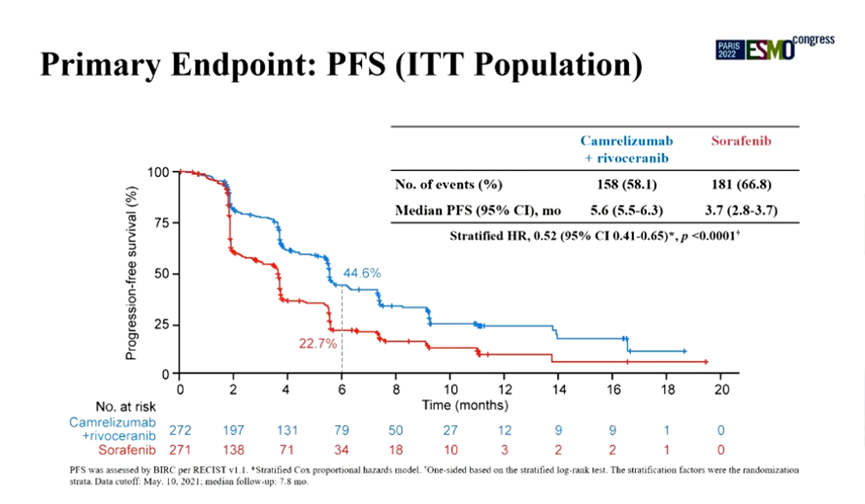
恒瑞的「双艾组合」本次在美国递交上市申请,是基于 III 期临床试验 SHR-1210-III-310(登记号:NCT03764293),其结果在去年 ESMO 年会上作为 LBA 报告发布。这是一项由肝癌著名专家秦叔逵作为全球 leading PI 的随机、开放标签、国际多中心 III 期研究,对比索拉非尼,主要终点为 IRC 评估的 PFS 和 OS,关键次要终点为 ORR。
研究共纳入 543 例受试者,亚洲人占比近 83%,非亚洲人群占 17.3%;BCLC C 占比 86%,PS=1 占比 56%,HBV 病因学占比 76.5%,局部治疗占比 59.2%。
SHR-1210-III-310 入组患者基线特征

截图来自:ESMOPPT 资料可向公众号发送「20220919」下载
结果显示,相比索拉非尼,双艾可显著改善 mPFS(5.6 个月 vs 3.7 个月),降低 48% 疾病进展或死亡风险,p<0.0001;可显著延长 mOS(22.1 个月 vs 15.2 个月), 降低 38% 死亡风险,p<0.0001。索拉非尼后续免疫治疗比例为 33.5%。亚组分析显示,HBV 病因学肝细胞癌似乎更能从双艾中获益。
ITT 人群中 PFS 主要终点数据

2、特瑞普利单抗
君实在美国的上市申报也颇为曲折。特瑞普利单抗是第一款向 FDA 递交 BLA 申请的国产 PD-1,还获得了优先审评资格,不过由于质控流程变更和现场核查受阻,收到了 FDA 发出的 CRL,后又再次向 FDA 申报上市。由于当前现场核查终于可以恢复,合作伙伴 Coherus 预估在 Q3 有望取得批准。
特瑞普利单抗的 BLA 是基于 JUPITER-02(一项随机、双盲、安慰剂对照、国际多中心 III 期临床研究)及 POLARIS-02(一项多中心、开放标签、II 期关键注册临床研究)的研究结果。
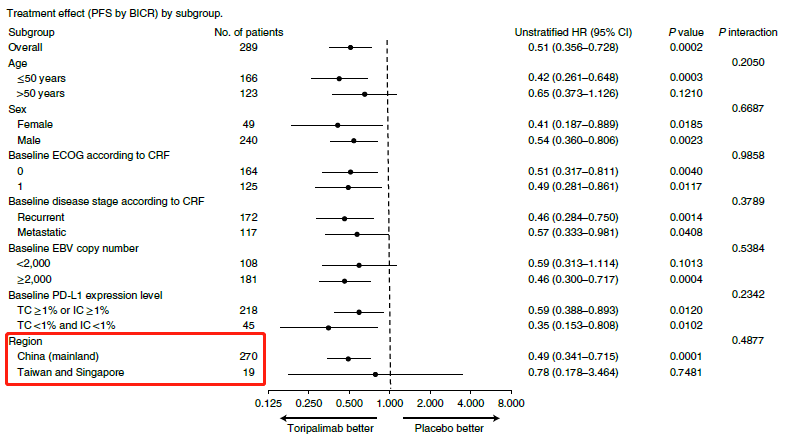
就 JUPITER-02 研究(NCT03581786)而言,该试验由中山大学肿瘤防治中心主任、院长徐瑞华教授牵头,研究成果在 ASCO 2021 上以全体大会「重磅研究摘要」(LBA)形式发表,亦于 2021 年 8 月获 Nature Medicine(IF=53.440)在线发表。
JUPITER-02 研究属于国际多中心 III 期临床,纳入患者均为亚洲患者,试验重点为 PFS。根据 Nature Medicine 文章报道,2018 年 11 月 10 日至 2019 年 10 月 20 日,共纳入 289 名患者,其中中国大陆 270 例,台湾和新加坡共 19 例。
来自:Nature Medicine
研究结果显示,对于未接受过系统性治疗的复发或转移性 NPC 患者,与安慰剂联合化疗组相比,特瑞普利单抗联合化疗组中位无进展生存期(PFS)显著延长,为 21.4 vs. 8.2 个月,延长 13.2 个月,并且特瑞普利单抗联合化疗可降低 48% 的疾病进展或死亡风险(HR=0.52,95%CI:0.37-0.73,双侧 p<0.0001)。
3、替雷利珠单抗
替雷利珠单抗用于食管鳞癌的 BLA 基于 RATIONALE 302 临床试验的结果,这是一项随机、开放性、多中心的全球 3 期试验(NCT03430843),旨在评价百泽安®相比研究者选择的化疗方案用于晚期或转移性 ESCC 患者二线治疗的有效性和安全性。
该项临床试验的结果已在 2021 年美国临床肿瘤学会年会(ASCO 2021)上公布。递交资料中还包括在 7 项临床试验中 1972 例接受百泽安®单药治疗患者的安全性数据。
根据 2021 ASCO 会议公布的临床数据,该研究纳入 512 例患者(中位年龄: 62,范围: 36-86 岁),包括 404 例(79%)来自亚洲 10 个国家 132 个分中心,以及 108 例(21%)来自北美和欧洲。CDE 登记平台显示,该临床试验的中国实际入组人数为 300 例,因此前述 404 例亚洲患者中预计 100 余例来自亚洲其他国家,总体中国以外招募患者数约 40%。
在 2022 ASCO 上,百济又发布了 RATIONALE-302 的亚洲亚组研究数据。
RATIONALE-302 临床试验结果

截图来自:Insight 数据库网页版
4、斯鲁利单抗
斯鲁利单抗是首款在一线小细胞肺癌治疗上获得 III 期临床 OS 改善的 PD-1 单抗。在此之后,日前君实生物刚刚宣布特瑞普利单抗也在 ES-SCLC 适应症上达到了主要终点。
2021 年 12 月 17 日,复宏汉霖举办全球研发日,介绍了这项临床试验的期中分析详细数据;2022 年 6 月,相应临床结果在 ASCO 大会上作为口头报告发表,更新随访数据也于 2022 年 12 月 ESMO Asia 上发布。此外,2022 年 9 月,ASTRUM-005 研究结果还发布于全球四大顶级医学期刊之一的 JAMA(IF:157.3)。
斯鲁利单抗一线 SCLC 已披露临床数据概览

截图来自:Insight 数据库网页版
纳入人群方面,ASTRUM-005 入组了来自 6 个国家 114 家中心的 585 例未接受过系统治疗的 ES-SCLC 患者,按 2:1 随机分组至斯鲁利单抗联合卡铂+依托泊苷(EC 方案)组(斯鲁利单抗组,389 例)和安慰剂联合 EC 方案组(化疗组,196 例)。虽然入组人群中不含美国人,不过包含约 31.5% 的高加索人种。
ASTRUM-005 研究分析显示,斯鲁利单抗联合化疗组的中位 OS 达 15.8 个月,较对照组显著延长 4.7 个月,OS 得到了明显改善,患者死亡风险降低 38%(HR=0.62,95%CI: 0.50~0.76)。亚裔人群中位 OS 达 15.9 个月,较对照组延长 4.8 个月(HR=0.63,95%CI: 0.49~0.81)。其独立影像评估委员会根据 RECIST v1.1 评估的中位 PFS 也获得了延长(5.8 vs. 4.3 个月;HR 0.47,95% CI: 0.38~0.58)。
海外新兴市场「多管齐下」,国产 PD-1 即将在美国摘取硕果
今年,国产 PD-1 已经释出多个利好消息,透露出在海外有望达到新的里程碑。
日前,Coherus 刚刚公布了 2023Q1 财报。作为这家生物类似药企业的重要转型产品,来自君实生物的 PD-1 特瑞普利单抗也被该企业寄予厚望作为关键产品推进,Coherus 也披露了关于特瑞普利单抗的最新进展和 23 年预期。
据 Coherus 表示,美国 FDA 已通知该公司将于 2023 年 5 月晚些时候对中国特瑞普利单抗进行生产现场检查,这是此前这款 PD-1 单抗在 FDA 未能在 22 年 12 月 23 日 PDUFA 决定日期如期获批的主要原因。基于此,Coherus 预计特瑞普利单抗将在 2023Q3 获批上市。
这家公司的 TIGIT 单抗同样来自君实生物的授权,将共同成为 I-O 管线中的关键组成。
Coherus 业务发展预期

截图来自:Coherus 2023 年 3 月资料
特瑞普利单抗所申报的鼻咽癌适应症在美国属于罕见癌种,也是 K 药、O 药等前辈尚未踏足的领域。基于这一未满足的临床需求,特瑞普利单抗有望拿到 FDA 的积极反馈。
而百济神州也已经透露,FDA 将于 23 年 Q2 对替雷利珠单抗进行现场检查,并在年内给出审评决议,二线治疗食管鳞癌。百济的全球多中心临床试验布局有望使其创新药能够更好满足海外监管机构的要求,为出海打下坚实基础。
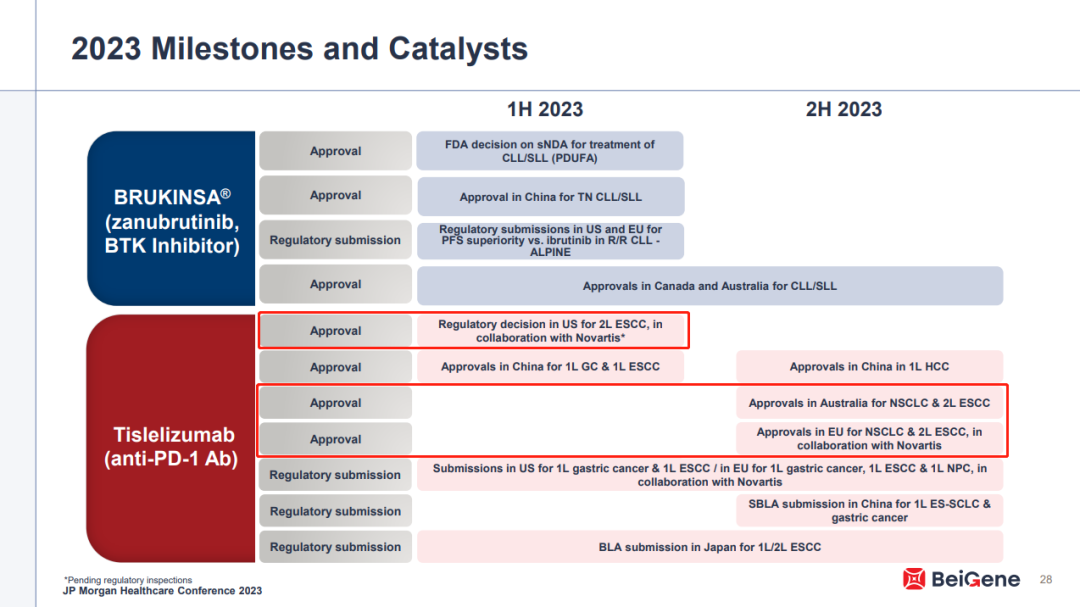
截图来自:百济神州 2023JPM
基于这些企业释放的积极信号,今年很可能成为国产 PD-1 真正的出海元年。兼之今年中国创新药的 License out 授权事件发生之频繁,继泽布替尼和西达基奥仑赛之后,中国创新药将继续向世界发出自己的声音。
全球化方面,百济神州是公认的行业翘楚。不仅踏足美国,百济的脚步还跨越了国际市场多个版图。
目前,替雷利珠单抗已经在全球 8 个国家或地区递交了新药上市申请,这些地区包括美国、欧盟、英国、瑞士、澳大利亚、新西兰、韩国、巴西等;申报适应症则包括食管鳞癌(ESCC)、非小细胞肺癌(NSCLC)等多个重要领域。其中澳大利亚和欧洲地区也将在今年内取得相关监管决定。
百济神州「替雷利珠单抗」当前临床试验布局

截图来自:Insight 数据库网页版
不仅百济,国内其他 PD-1 参与者也早已开始把目光投向美国之外的广泛地区,第一步布局欧洲,然后通过对外合作/授权向东南亚等广泛地区渗透。
君实生物将特瑞普利单抗的北美和加拿大权益授予 Coherus,欧洲则自主提交上市申请;此外,从去年年末到今年初,又通过 3 笔交易将海外布局拓展到了中东、南非、北非、东南亚等地区。
君实生物「特瑞普利单抗」对外合作和授权

截图来自:Insight 数据库网页版
2022 年 12 月 26 日,君实生物与 Hikma 公司宣布达成合作,授予在约旦、沙特阿拉伯、阿联酋、卡塔尔、摩洛哥、埃及等中东和北非地区共 20 个国家开发和商业化的独占许可,并可获得合计最高达 1,200 万美元的付款,外加销售净额近 20% 的阶梯分成;
2023 年 3 月 28 日,君实生物与康哲药业子公司康联达生技共同宣布,将设立合资公司在东南亚地区 9 个国家,包括泰国、文莱、柬埔寨、印度尼西亚、老挝、马来西亚、缅甸、菲律宾、越南,对特瑞普利单抗合作开发和商业化;
5 月 5 日,君实生物与瑞迪博士实验室签署协议,同意授予许可于巴西、墨西哥、哥伦比亚、阿根廷、秘鲁、智利、巴拿马、乌拉圭、印度及南非开发及独占地商业化特瑞普利单抗;且瑞迪博士实验室可选择将许可范围扩大至涵盖澳大利亚、新西兰以及其他 9 个国家。
而康方生物也在 4 月 12 日宣布,与正大天晴药业集团共同合资的正大天晴康方与 Specialised Therapeutics(ST)公司签署了一项合作与许可协议,授予 ST 公司派安普利单抗在澳大利亚、新西兰、巴布亚新几内亚,以及新加坡、马来西亚等东南亚 11 个国家的独家销售权。正大天晴康方则仍保留派安普利单抗在全球范围内的开发权益。

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 195
195

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 198
198

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 208
208